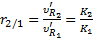Абсорбция.Явление и процесс концентрирования вещества на поверхности раздела фаз и в объёме пор твёрдого тела. В этом процессе различают адсорбент (поглотитель), адсорбат/адсорбтив (поглощаемое). Первое и основное требование к адсорбенту – развитая поверхность (пористость), т.е. масса адсорбента состоит из хаотической или регулярной системы пор (ополостей, полость), и соединяющих их каналов и объёмов. Количественной характеристикой развитости поверхности адсорбента является величина его удельной поверхности:
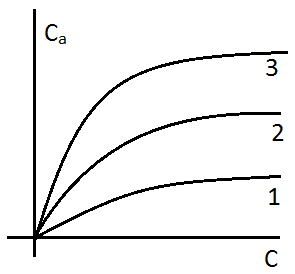
S0 увеличивается с увеличением степени дисперсности частиц сорбента. Но ещё в большей степени S0 связана со структурой внутренних пор и каналов. Окись алюминия, например, имеет уд-ю поверхность 250-300 м2/г. Силикагель – 300..700 м2/г. В качестве носителей для газожидкостной хроматографии используются материалы, называемые силохром. Цветохром имеет удельную поверхность 1..3. Адсорбция связана с особым энергетическим состоянием атомов и молекул адсорбента на поверхности, в отличие от его частиц в объёме, которые испытывают в среднем одинаковые по всем направлениям взаимодействия со стороны окружающих частиц. Поверхностный слой адсорбента обладает свободной поверхностной энергией за счёт своей оголённости. И эта поверхностная энергия может быт снижена за счёт адсорбционного взаимодействия с молекулами или атомами другой природы, т.е. частицами адсорбата. Таким образом адсорбционное является одним из проявлений сил поверхностного натяжения. По силе взаимодействия адсорбента и адсорбата различают физическую адсобцию или просто адсорбцию и хемосорбцию. Переход от сорбции к хемосорбции или отличии их друг от друга не является чётким: это деление в известной степени произвольно, но тем не менее существует ряд критериев, позволяющих отличить один хемосорбции от других: · Природа адсобционной связи и изменение электронных характеристик тела. При физической адсорбции сохраняется индивидуальность отдельных частиц. Свойства ТТ при этом не меняется. Адсорбция обеспечивает в основном силы Ван-Дер –Ваальса. При хемосорбции в результате взаимодействия адсорбента и адсорбата, возникает состояние, близкое к химической связи, возможен прямой переход электрона. Этот переход может вызывать изменение электропроводимости ТТ, изменение работы выхода электрона, а с другой стороны хемосорбция вызывает изменение структуры адсорбированной молекулы. Природа сил при хемосорбции – донорно-акцепторная связь и водородная связь. Донорно-акцепторное взаимодействие обеспечивает специфический характер хемосорбции. · Количество адсорбированного вещества. При физической адсорбции отсутствуют стехиометрические отношения между адсорбатом и адсорбентом и при благоприятных Т и Р может быть покрыта полимолекулярным слоем адсорбата. При хемосорбции ввиду её специфичноти поверхность адсорбента может быть насыщена лишь монослоем. Обратимость адсорбции Для физической адсорбции характерно быстрое установление равновесия и физическая адсорбция всегда обратима. Хемосорбция, как правило, протекает с небольшой скоростью при низких температурах и возрастает при определённых температурных интервалах, что часто используется для её распознания. Хемосорбция плохо обратима. Десорбция химически адсорбированных веществ требует высоких температур или снижение давления. Возможной формой необратимой хемосорбции – удаление продуктов необратимой хемосорбции требует использование химических процедур (например, температурное окисление). При хемосорбции адсорированные молекулы не могут перемещаться по поверхности адсорбента – их положение фиксированно. Такая адсорбция называется локализованной. Хемосорбция идт на особых участках поверхности, называемых активные центры, обсепечивающих селективный характер хемосорбции. Физическая адсорбция может быть как локализованной, так и делокализованной с возростанием Р молевула приобертает подвижность, и локализованная адсорбция переходит в нелокализованную. Обычно считают, что физическая адсорбция идёт на энергетически однородных поверхностях. Теплота адсорбции Лекция № 3 от 21.09.2011 Адсорбция является процессом самопроизвольным и экзотермическим, т.е. сопровождается выделением тепла, называемой теплотой адсорбции. Физической основой теплоты адсорбции является уменьшение скорости и кинетической энергии молекул при адсорбции. Теплота физической адсорбции находится в пределах соответствующих теплот конденсации. Эти значения теплот – 10..50 кДж/моль (80..120 кДж/моль). При хемосорбции связи сорбирующихся молекул с поверхностью приближаются по своим энергиям к энергиям химических связей, и поэтому теплоты хемосорбции по своим значениям приближаются к значениям тепловых эффектам реакции (100..200+ кДж/моль). Температурный интервал адсорбции Физическая адсорбция очень подвержена влиянию температуры: с повышением температуры физическая адсорбция уменьшается. Хемосорбция может происходить и при низких, и при высоких температурах, при которых физическая адсорбция пренебрежительно мала. Причём возможны различные температурные формы хемосорбции одного и того же вещества на одной и той же поверхности. Для определения таких различных температурных форм используется метод программирования термодесорбции. Хемосорбция в большей степени приложима к явлениям гетерогенного катализа (катализ - явление ускорения химической реакции,и может быть гомо/гетерогенным). Физическая адсорбция, при которой сохраняется индивидуальность адсорбированных частиц, в большей степени приложима к процессам хроматографического разделения. Поэтому остановимся на количественном описании процесса адсорбции. Одной из наиболее распространённых теорий адсорбции является теория Ленгмюра (уравнение изотермы Ленгмюра). Эта теория основана на ряде допущений: 1. Адсорбция локализована и происходит на активных центрах адсорбции. 2. Эти центры адсорбции равноценны в энергетическом отношении (говорят о энергетически однородной поверхности). 3. На каждом центре адсорбируется только 1 молекула. 4. Взаимодействие адсорбированных молекул между собой отсутствует. 5. Процесс адсорбции представляется как результат установления динамического равновесия в распределении молекул между газовой фазой и поверхностью сорбента. Адсорбция (А) в равновесном состоянии зависит от температуры, давления газа (Р) или концентрации адсорбирующегося вещества (С), зависит от природы адсорбата и адсорбента, и увеличивается с ростом поверхности адсорбента. Зависимость между количеством адсорбированного вещества (А), адсорбируемого из жидкой или газовой фазы, и его концентрацией в этой фазе (С) или давлением газовой смеси, из которой оно адсорбируется (Р) при постоянной температуре выражается уравнением изотермы адсорбции. В понятиях или терминах химической кинетики адсорбционное равновесие характеризуется равенством скоростей адсорбции и десорбции:
k1 и k2 – константы скоростей адсорбции и десорбции соответственно, с – концентрация адсорбата в газовой фазе пропорционально давлению в газовой фазе. Θ – доля занятых адсорбционных центров поверхности. b – адсорбционный коэффициент или константа адсорбционного равновесия, которая связана с энергетической характеристикой данного адсорбционного процесса. Уравнения (*) и (**) – уравнения изотермы Ленгмюра, и выражается графиками. При малых концентрациях или давлениях количество адсорбированного вещества А прямо пропорционально концентрации:
где Г – коэффициент Генри При большей концентрации адсорбирующегося вещества Θ стремится к 1, вся поверхность насыщается адсорбированным веществом. Хроматографические процессы стремятся осуществлять в области Генри, когда существует линейная зависимость между количеством вещества в газовой фазе и количеством молекул на поверхности, т.е. в области разбавленных паро-газовых смесей или растворов. Абсорбция Процесс избирательного поглощения газа или пара массой или объёмом жидкого поглотителя. Различают физическую абсорбцию и химическую абсорбцию (хемосорбцию). При физической абсорбции химическое взаимодействие между газом и жидкостью отсутствует. Во втором случае образуются химические соединения. Пример: SO3 + H2O -> H2SO4. N2O5 + H2O -> 2HNO3. NH3 + H2O -> NH4OH. Физические основы процесса адсорбции Лекция № 4 от 28.09.2011 Растворимость газов в жидкостях зависит от свойств газов и жидкостей - температуры и давления, в данном случае парциального давления. Закон Генри: Равновесное парциальное давление пропорционально содержанию растворенного газа в жидкости. (И тут бля отсутствует что-то, так как я опоздал, а Светка «не рисует»)
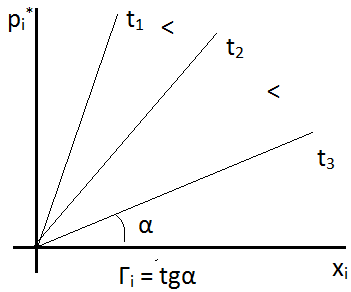
1. Для растворов с низкой концентрацией: для хорошо растворяющихся газов при больших концентрациях наблюдается отклонение от закона Генри. Коэффициент Генри зависит так же от температуры: при повышении температуры растворимость газов уменьшается и уменьшается коэффициент Генри. Графически это выглядит так: см. рисунок. 2. Закон хорошо выполняется при умеренном давлении и не высоких температурах 3. При отсутствии химического взаимодействия газа с растворяющей жидкостью Диффузия Процесс выравнивания концентрации по всему объёму раствора под действием теплового движения молекул. Этот процесс, как процесс, приводящий к равновесию, является процессом самопроизвольным и необратимым. Движущей силой процесса является градиент концентрации:
где j – диффузионный поток [г/см2с], D зависит от природы веществ – растворяющегося вещества и растворителя - и зависит от температуры. Диффузия приводит к перемешиванию (гомогенизации) смеси. В общем случае перемешивание может происходить вследствие: 1. В покоящихся средах – за счёт диффузии 2. Путём механического перемешивания 3. Под действием сил тяжести – такое перемешивание называется конвекцией. Природа сорбционных сил Сорбционные явления возникают в результате действия сил межмолекулярного взаимодействия, т.е. сил, возникающих между валентно насыщенными, химически устойчивыми молекулами собрата и сорбента. Среди сорбционных сил различают: 1. Донорно-акцепторное взаимодействие – возникает между молекулами, имеющую свободную электронную пару (молекула – «донор»), а другая молекула имеет свободную электронную орбиталь и называется «акцептор». Донорно-акцепторное взаимодействие характеризуется силой до 200 кДж/моль. Частный случай донорно-акцепторного взаимодействия является водородная связь (до 80 2. Силы Ван-дер-Ваальса. Эти силы обладают меньшим энергетическим эффектом (порядка 10 кДж/моль). Проявляются между любыми частицами на расстояниях, исключающих перекрывание электронных орбиталей. Природа этих сил – электромагнитное взаимодействие электронов и ядер атомов одной молекулы и электронов и атомов другой молекулы. Это взаимодействие возникает на расстояниях 0,2..0,5 нм, а химическая ковалентная связь – 0,1..0,15 нм. Энергия притяжения Ван-дер-Ваальсовских сил может быть представлена суммой трёх составляющих:
Индукционный момент возникает: постоянный диполь поляризует неполярную молекулу и наводит в ней дипольный момент. Этот эффект зависит от способности неполярной молекулы поляризоваться (а – поляризуемость молекулы). Дисперсионный эффект. Носит универсальный характер, и определяется взаимодействием неполярных молекул. В любой момент времени в атомной системы неполярной молекулы может происходить кратковременное смещение центра тяжести электрических зарядов – образуется мгновенный диполь, который индуцирует дипольный момент в соседних молекулах. Движение мгновенных диполей перестаёт быть независимым и становится синхронным. Появление мгновенных диполей и их исчезновение происходит в такт с другими. В результате соседствующие частицы испытывают взаимопритяжение. Важной чертой сил Ван-дер-Ваальса является их универсальность – присущи всем атомам и молекулам. Второй важной чертой является их коротко действие – сила взаимодействия обратно пропорциональна 6-й степени расстояния между ними. Межмолекулярное взаимодействие определяет повышенную температуру кипения воды при небольшом её молекулярном весе. Является причиной отличия реальных газов от идеальных. Межмолекулярное взаимодействие проявляется в таких явлениях как адгезия (сцепление или склеивание разнородных по химической природе жидкостей или твёрдых тел/веществ), когезия (сцепление однородных по химической природе частиц вещества)(следствие когезии – отсутствие температуры кипения для полимеров), адсорбция (используется при хроматографическом разделении и в явлении гетерогенного катализа). Сорбционное равновесие. Механизм хроматографического разделения.
Лекция № 5 от 05.10.2011 На основе теории равновесной хроматографии выводится уравнение скорости движения концентрационной зоны вдоль колонки:
где α – объёмная скорость потока газоносителя [л/мин], υ – объём газовой фазы в колонке на единицу её длинны, υa – объём адсорбента или неподвижной жидкой фазы на единицу длинны колонки, В области малых концентраций зависимость
Выводы, которые можно сделать на основе этого уравнения: 1. Если α = 0, то υ = 0, т.е. поток газоносителя есть движущая сила хроматографического процесса. 2. Физической основой процесса хроматографического разделения могут быть либо различия либо в летучести разделяемых веществ (коррелирует с температурой кипения веществ), либо различия в селективности взаимодействия разделяемых веществ с сорбентом, либо сочетание обоих этих факторов. А это значит, что в принципе нет такой пары веществ, которые нельзя было бы разделить методами газовой хроматографии. Для количественной характеристики качества разделения можно использовать значения относительного удерживания.
|


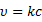 . В нашем случае:
. В нашем случае: 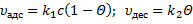 .
.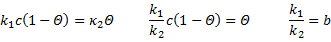

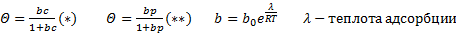
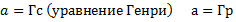
 Закон Генри хорошо соблюдается при:
Закон Генри хорошо соблюдается при:
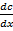 – градиент концентрации по одному из направлений, D – коэффициент диффузии [см2/c].
– градиент концентрации по одному из направлений, D – коэффициент диффузии [см2/c].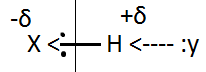 кДж/моль). В качестве акцептора не поделённой электронной пары возникает свободная электронная орбиталь атома водорода. Поляризация происходит в случае, если атомы имеют большее сродство к электрону (см. рисунок).
кДж/моль). В качестве акцептора не поделённой электронной пары возникает свободная электронная орбиталь атома водорода. Поляризация происходит в случае, если атомы имеют большее сродство к электрону (см. рисунок).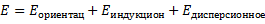
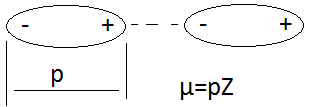 Ориентационный эффект вызывается взаимодействием неполярного взаимодействия с полярным.. Чем больше дипольный момент и меньше расстояние между диполями, тем взаимодействие сильнее. С ростом температуры этот эффект уменьшается:
Ориентационный эффект вызывается взаимодействием неполярного взаимодействия с полярным.. Чем больше дипольный момент и меньше расстояние между диполями, тем взаимодействие сильнее. С ростом температуры этот эффект уменьшается:
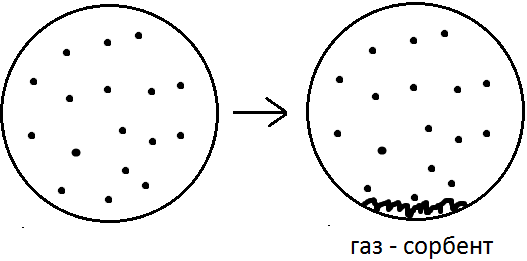 Через какое-то время возникнет состояние равновесия в распределении молекул между газовой фазовой и в приповерхностном слое твёрдого тела (сорбент). Это равновесие носит динамический характер, поскольку адсорбция и десорбции не прекращаются, но каждый вновь сорбированной молекуле будет соответствовать одна десорбированная. Такое состояние количественно будет характеризоваться коэффициентом распределения:
Через какое-то время возникнет состояние равновесия в распределении молекул между газовой фазовой и в приповерхностном слое твёрдого тела (сорбент). Это равновесие носит динамический характер, поскольку адсорбция и десорбции не прекращаются, но каждый вновь сорбированной молекуле будет соответствовать одна десорбированная. Такое состояние количественно будет характеризоваться коэффициентом распределения:
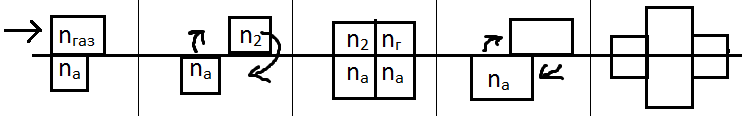 Приведём газовую фазу в направленное движение, т.е. сделаем из неё газ-носитель. Через какое-то время части концентрационной зоны сорбата окажутся частично разделёнными между собой вдоль поверхности сорбента. Чтобы восстановить состояние равновесия в освободившемся объёме газовой фазы над участком поверхности, где сконцентрированы сорбированные молекулы и на участке поверхности, куда сместились молекулы сорбата, находящиеся в газовой фазе, начинается противоположно направленные процессы сорбции и десорбции, но разнесённые по поверхности или вдоль поверхности сорбента. В идеальном случае этот процесс – равновесный, а именно 1 молекула сорбируется, 1 десорбируется, а в целом концентрационная зона движется вдоль поверхности сорбента в направлении движения газа-носителя. Движущаяся концентрационная зона сорбата занимает определённый объём или участок разделительного хроматографического устройства (колонки или хроматографической пластинки) и этот элемент колонки, на котором достигается равновесное распределение сорбата между газом-носителем и сорбентом в условиях движения подвижной фазы называется «теоретической тарелкой».
Приведём газовую фазу в направленное движение, т.е. сделаем из неё газ-носитель. Через какое-то время части концентрационной зоны сорбата окажутся частично разделёнными между собой вдоль поверхности сорбента. Чтобы восстановить состояние равновесия в освободившемся объёме газовой фазы над участком поверхности, где сконцентрированы сорбированные молекулы и на участке поверхности, куда сместились молекулы сорбата, находящиеся в газовой фазе, начинается противоположно направленные процессы сорбции и десорбции, но разнесённые по поверхности или вдоль поверхности сорбента. В идеальном случае этот процесс – равновесный, а именно 1 молекула сорбируется, 1 десорбируется, а в целом концентрационная зона движется вдоль поверхности сорбента в направлении движения газа-носителя. Движущаяся концентрационная зона сорбата занимает определённый объём или участок разделительного хроматографического устройства (колонки или хроматографической пластинки) и этот элемент колонки, на котором достигается равновесное распределение сорбата между газом-носителем и сорбентом в условиях движения подвижной фазы называется «теоретической тарелкой».
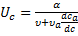
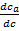 – зависимость концентрации сорбата в неподвижной фазе от его концентрации в газе-носителе.
– зависимость концентрации сорбата в неподвижной фазе от его концентрации в газе-носителе.
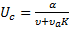
 Поскольку К для случая взаимодействия разных веществ сорбатов с одной и той же поверхностью сорбента в одних и тех же условиях различны, то и скорости движения концентрационных зон разных веществ вдоль колонки будут различны и обратно пропорциональны сорбируемости, поэтому эти вещества способны разделяться в хроматографическом процесс. Если К для 2х или более веществ в определённых условиях одинаковы (т.е. равны или очень близки по значению), то эти вещества в указанных условиях разделяться не будут или будут разделяться очень плохо. Значит для достижения эффекта разделения следует поменять сорбент или неподвижную жидкую фазу, либо менять условия хроматографического анализа.
Поскольку К для случая взаимодействия разных веществ сорбатов с одной и той же поверхностью сорбента в одних и тех же условиях различны, то и скорости движения концентрационных зон разных веществ вдоль колонки будут различны и обратно пропорциональны сорбируемости, поэтому эти вещества способны разделяться в хроматографическом процесс. Если К для 2х или более веществ в определённых условиях одинаковы (т.е. равны или очень близки по значению), то эти вещества в указанных условиях разделяться не будут или будут разделяться очень плохо. Значит для достижения эффекта разделения следует поменять сорбент или неподвижную жидкую фазу, либо менять условия хроматографического анализа.