Наприклад,. ½ ½ ½ ½. ?мологічний ряд спиртів Назва спирту Формула Метанол CH3ОН Етанол C2H5ОН Пропанол C3H7ОН Бутанол C4H9ОН
За розміщенням гідроксильної групи у вуглецевому ланцюзі спирти класифікують на первинні (група –ОН розміщена при первинному атомі вуглецю), вторинні (гідроксильна група розміщена при вторинному атомі вуглецю) і третинні (група –ОН знаходиться при третинному атомі вуглецю):
13.1.1. Одноатомні спирти Одноатомні спирти (R-OH) мають загальну формулу CnH2n+1-OH і суфікс – ол. Гомологічний ряд спиртів
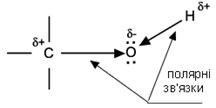
Фізичні властивості Спирти мають більш високі температури плавлення та кипіння, більшу розчинність у воді, ніж відповідні вуглеводні Така різка відмінність фізичних властивостей спиртів від алканів зумовлена в першу чергу тим, що спирти є полярними сполуками (атом кисню більш електронегативний в порівнянні з атомом вуглецю, тому він зміщує до себе електронну густину від атома вуглецю і водню). Вони мають два полярні зв’язки С-О та О-Н. Існування на атомах гідроксильної групи часткових зарядів різного знаку приводить до міжмолекулярної взаємодії гідроксильних груп і утворення водневих зв’язків:
У результаті такої взаємодії відбувається асоціація молекул спирту. Водневі зв’язки значно слабші за ковалентні, однак їх утворення істотно зменшує леткість, підвищує температуру кипіння, тому що агрегати, які утворюються, мають більшу молекулярну масу. Наприклад, етан кипить при -89°С, тоді як етанол при 78, 5 °С. Метанол і етанол змішуються з водою в будь-яких співвідношеннях; зі збільшенням молекулярної маси розчинність спиртів у воді зменшується.
Одержання 1) метанол одержують із синтез-газу в присутності каталізатора (ZnO, Сu): СО + 2Н2 ® СН3ОН синтез газ метанол 2) етанол одержують: a) гідратацією етилену: СН2=СН2 + Н2О ® СН3–СН2–ОН етен етанол б) бродінням крохмалю (або целюлози): крохмаль ® С6Н12О6–ферменти®2С2Н5ОН + 2СО2 Джерелом крохмалю є зерно, рис, картопля. 3) гідратація алкенів (згідно правила Марковнікова):
4) гідроліз галогенопохідних вуглеводнів: СH3–СH2–Br + H2O ® СH3–CH2–OH + HBr брометан етанол
Хімічні властивості Властивості спиртів R-OH визначаються наявністю полярних зв'язків Oδ -–Hδ + і Cδ +–Oδ -, і неподілених електронних пар на атомі кисню.
Для спиртів характерні реакції за участю зв’язку О-Н, зв’язку С-О і окиснювальні реакції. а) Реакції з розривом зв'язку RO–H 1) з лужними металами утворюючи солі - алкоголяти 2СH3CH2OH + 2Na ® 2СH3CH2ONa + H2 етилат натрію 2) з органічними кислотами (реакція ЕСТЕРИФІКАЦІЇ - утворення складних ефірів - естерів).
б) Реакції з розривом зв'язку R–OH 3) з галогеноводнями: R–OH + HBr ® R–Br + H2O в) Реакції окиснення 4) при дії окисників спирти окиснюються до альдегідів, які в свою чергу окиснюються до карбонових кислот:
спирти альдегіди карбонові кислоти г) Дегідратація 5) внутрішньомолекулярна дегідратація приводить до утворення алкені в. Реакцію проводять при температурі вищій, ніж 140°С в присутності сульфатної кислоти як водовідбірного засобу: CH3–CH2–OH ––t°> 140°C, H2SO4® CH2=CH2 + H2O етанол етен
6) міжмолекулярна дегідратація приводить до утворення простих ефірів - етерів. Реакцію проводять при температурі нижчій, ніж 140°С в присутності сульфатної кислоти як водовідбірного засобу:
CH3–CH2–OH + НО–CH3 –– t°< 140°C, H 2 SO 4® CH3–CH2–O–CH3 етанол метанол етилметиловийй етер
13.1.2. Багатоатомні спирти Одержання 1) окиснення етилену: СН2=СН2 –[O], H2O® СН2¾ СН2 етен ½ ½ OH OH етиленгліколь 2) гідратація галогенпохідних вуглеводнів: СН2¾ СН2 ––NaOH® СН2¾ СН2 ½ ½ ½ ½
|