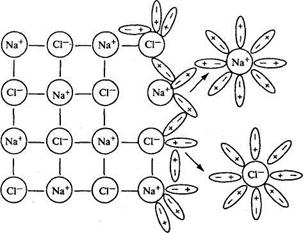
Факторы, влияющие на степень электролитической диссоциацииСтепень диссоциации зависит от природы электролита и растворителя, концентрации раствора, температуры, присутствия одноименного иона и других факторов. 1. Природа электролита и растворителя. Диссоциация электролитов с ионной и ковалентной полярной связями протекает различно. При растворении в воде ионных соединений, например хлорида натрия NaCl, дипольные молекулы воды + - ориентируются вокруг ионов Na+ и хлорид-ионов С1-. При этом положительные полюсы молекул воды притягиваются к хлорид-ионам С1-, отрицательные полюсы - к положительным ионам Na+. Происходит взаимодействие между молекулами растворителя и ионами электролита. Этот процесс называется гидратацией и является первой стадией диссоциации. В результате него притяжение между ионами в кристаллической решетке NaCl ослабевает и кристаллическая решетка разрушается. В раствор переходят уже гидратированные ионы Na+ и С1- (рис. 1.1), т.е. ионы окружены гидратной оболочкой, состоящей из диполей воды.
Рис. 1.1. Схема электролитической диссоциации хлорида натрия в водном растворе
Диссоциация ионных соединений протекает полностью. Так диссоциируют щелочи и соли: КС1, LiNO3, Ва(ОН)2 и др. При растворении в воде веществ с полярной ковалентной связью, например молекул НС1, дипольные молекулы электролита взаимодействуют с дипольными молекулами воды. Под действием молекул воды происходит сильное смещение связывающих электронов в молекуле НС1 и связь Н – Cl становится ионной. В результате диссоциации электролита в растворе образуются гидратированные ионы (рис. 1.2).
Рис. 1.2. Схема диссоциации электролита с полярной связью в водном растворе Таким образом, при растворении в воде хлороводорода происходит процесс, который схематически можно выразить уравнением Н2О + НС1 → Н3О+ + С1-. Такие же процессы происходят и при растворении в воде других кислот: Н2О + HNO3 → Н3О+ + NO3-. Гидратированные оболочки (или сольватированные в случае органического растворителя) ослабляют электростатическое взаимодействие в большей или меньшей степени в зависимости от диэлектрической постоянной растворителя ε. Последняя величина показывает, во сколько раз сила взаимодействия двух электрических зарядов в среде растворителя меньше, чем в вакууме. Чем больше е растворителя, тем лучше происходит диссоциация. Например, диссоциация H2SO4 происходит легче в воде (ε = 81), чем в этаноле (ε = 27) или в бензоле (ε = 2). 2. Концентрация раствора электролита. Чем ближе друг к другу в растворе находятся катионы и анионы, тем сильнее их притяжение друг к другу, и наоборот. Расстояние между ионами зависит от концентрации раствора. Повышение концентрации ведет к частому столкновению, что приводит к образованию молекул и уменьшению степени диссоциации. При разбавлении раствора расстояние между ионами возрастает и степень диссоциации увеличивается, так как преобладает процесс распада молекул на ионы. 3. Температура. При повышении температуры степень диссоциации слабых электролитов, как правило, возрастает. Это объясняется тем, что усиливается тепловое движение ионов и облегчается процесс диссоциации электролита. 4. Влияние одноименного иона. Если в растворе два электролита имеют общий ион, то этот ион называется одноименным. Например, раствор уксусной кислоты и ее соль ацетат натрия имеют общий ион СН3СОО-. При добавлении к раствору слабой кислоты ее соли происходит уменьшение степени диссоциации кислоты. Объясним это на примере уравнений диссоциации СН3СООН и ее соли ацетата натрия CH3COONa: СН3СООН ↔ CH3COO- + H+; СН3СООNa → CH3COO- + Na+ Ацетат натрия - сильный электролит и в растворе полностью распадается на ионы. Добавление к раствору уксусной кислоты ацетата натрия увеличивает концентрацию одноименных ацетат-ионов СН3СОО-. Увеличение концентрации ацетат-ионов по принципу Ле Шателье смещает равновесие диссоциации уксусной кислоты влево, т.е. в сторону образования молекул уксусной кислоты. Увеличивая концентрацию ацетата натрия, можно в конечном итоге полностью подавить диссоциацию уксусной кислоты. Добавление небольших количеств соляной кислоты, дающей одноименный ион Н+, также подавляет диссоциацию уксусной кислоты. Таким образом, слабые кислоты в присутствии своей соли или сильной кислоты почти не распадаются на ионы. То же самое можно сказать и о слабых основаниях, диссоциация которых подавляется добавлением к раствору щелочи или соли с одноименным катионом. Степень диссоциации электролитов имеет большое значение в качественном анализе. По величине степени диссоциации различных кислот можно предсказать растворение осадка в этих кислотах. Например, оксалат бария ВаС2О4 не будет растворяться при комнатной температуре в уксусной кислоте, так как эта кислота более слабая, чем щавелевая. В то же время соляная и азотная кислоты, как более сильные, вытесняют щавелевую кислоту из ее соли и легко растворяют оксалат бария. По этой же причине соли ВаСrО4, СаС2О4 и ZnS растворяются в соляной кислоте, но не растворяются в уксусной.
|