Еталони розв’язання типових задач. Задача 1. Розрахувати тепловий ефект реакції: 2NaOH(к.) + CO2(г.) Na2CO3(к.) + H2O, якщо: Ноутв
Задача 1. Розрахувати тепловий ефект реакції: 2NaOH(к.) + CO2(г.) Розв’язання: Тепловий ефект хімічної реакції обчислюється по стандартних теплотах утворення за формулою: з врахуванням відповідних стехіометричних коефіцієнтів, тобто: Тобто це екзотермічна реакція. Задача 2. Чи є можливою реакція: SiO2(к.) + 2NaOH(р.) Розв’язання: Для відповіді на питання задачі необхідно обчислити зміну енергії Гіббса в даній реакції за формулою: Задача 3. Питома теплота топлення свинцю ( Розв’язання: Застосовуючи питому теплоту топлення, обчислюємо теплоту топлення 0,25кг свинцю:
Формула для Задача 4. При 80оС реакція закінчується за 8 хв. Через скільки хвилин вона закінчиться при 100оС, коли температурний коефіцієнт (g) дорівнює 2? Розв’язання: За правилом Ван–Гоффа при збільшені температури швидкість реакції збільшиться в:
при цьому інтервал перебігу реакції (Dtкін.) зменшиться в 4 рази:
Задача 5. В синтезі аміаку (N2 + 3H2 = 2NH3) рівновага встановилась при наступних концентраціях: [N2] = 2,5моль/л, [H2] = 1,8моль/л, [NH3] = 3,6моль/л. Розрахуйте константу рівноваги цієї реакції і вихідні концентрації азоту та водню. Розв’язання: Константа хімічної рівноваги за рівноважними концентраціями обчислюється за формулою:
За рівнянням реакції:
С(вихідне) = С(прореаг.) + [С(рівноважна)] = 1,8 + 2,5 = 4,3 моль/л
За рівнянням реакції:
С(вихідна) = 1,8 + 5,4 = 7,2моль/л Задача 6. Реакція іде за рівнянням: 4HCl + O2 = 2H2O + 2Cl2. В якому напрямку зміститься хімічна рівновага, якщо концентрації усіх реагуючих речовин збільшити в 2 рази? Розв’язання:За законом діючих мас швидкість прямої і оберненої реакції дорівнюють:
При збільшені концентрації усіх речовин в 2 рази:
Швидкість прямої реакції зросла в 32 рази, а швидкість оберненої — тільки в 16 разів, отже хімічна рівновага зміститься в напрямку прямої реакції. Задача 7. Рівновага хімічної реакції: 2NO + O2 = 2NO2 встановилась при слідуючи концентраціях реагуючих речовин: [NO] = 0,5моль/л, [O2] = 0,7моль/л, [NO2] = 2,1моль/л. Як зміниться швидкість обох реакцій, якщо тиск в системі зменшити в 2 рази? Куди зміститься хімічна рівновага? Розв’язання: До зменшення тиску:
При зменшені тиску в 2 рази концентрації усіх речовин зменшаться в 2 рази і тоді:
Швидкість прямої реакції зменшилась в:
Швидкість оберненої реакції буде більше, тому хімічна рівновага реакції зміститься в напрямку оберненої реакції.
|

 Na2CO3(к.) + H2O, якщо:
Na2CO3(к.) + H2O, якщо: 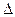 Ноутв.(NaOH) = –426,6 кДж/моль,
Ноутв.(NaOH) = –426,6 кДж/моль, 
 = 5760 Дж
= 5760 Дж
 = 9,59 Дж/К.
= 9,59 Дж/К.
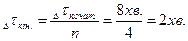
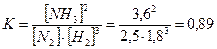
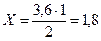 моль (N2(прореаг.) — С(прореаг.))
моль (N2(прореаг.) — С(прореаг.)) моль (Н2(прореаг.) — С(прореаг.))
моль (Н2(прореаг.) — С(прореаг.))





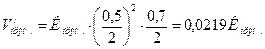

 , а оберненої в:
, а оберненої в:



