Тиоцианометрическое титрование.Тиоцианатометрическое титрование основано на осаждении ионов Ag+ (или Ag+ + SCN- = AgSCN↓. Определяют Ag+ или Тиоцианатометрическое определение галогенов выполняют по методу Фольгарда. Суть его можно выразить схемами: Cl- + Ag+ (избыток) → AgCl + Ag+ (остаток); Ag+ (остаток) + SCN-→ AgSCN↓. Иначе говоря, к жидкости, содержащей Cl-, приливают избыток титрованного раствора нитрата серебра. Затем остаток AgNO3 обратно оттитровывают раствором тиоцианата и вычисляют результат. Индикатор в методе Фольгарда – насыщенный раствор NH4Fe(SO4)2∙12H2O. Пока в титруемой жидкости имеются ионы Ag+, прибавляемые анионы SCN- связываются с выделением осадка AgSCN, но не взаимодействуют с ионами Fe3+. Однако после точки эквивалентности малейший избыток NH4SCN (или KSCN) вызывает образование кроваво-красных ионов [Fe(SCN)]2+ и [Fe(SCN)2]+. Вследствие этого удается определить эквивалентную точку. Тиоцианатометрические определения применяют чаще, чем оргентометрические. Присутствие кислот не мешает титрованию по методу Фольгарда и даже способствует получению более точных результатов, так как кислая среда подавляет гидролиз соли Fe3+. Метод позволяет определять ион Cl- не только в щелочах, но и в кислотах. Определению не мешает присутствие Ba2+, Pb2+, Bi3+ и некоторых других ионов. Однако если в анализируемом растворе имеются окислители или соли ртути, то применение метода Фольгарда становится невозможным: окислители разрушают ион SCN-, а катион ртути осаждает его. Щелочной исследуемый раствор нейтрализуют перед титрованием азотной кислотой, иначе ионы Fe3+, входящие в состав индикатора, дадут осадок гидроксида железа (III).
5.4. Приготовление стандартизированного раствора нитрата серебра Первичными стандартами для стандартизации раствора нитрата серебра служат хлориды натрия или калия. Готовят стандартный раствор хлорида натрия и приблизительно 0,02 н. раствор нитрата серебра, стандартизируют второй раствор по первому. Приготовление стандартного раствора хлорида натрия. Раствор хлорида натрия (или хлорида калия) приготовляют из химически чистой соли (или из фиксаналов). Молярная масса эквивалента хлорида натрия равна его молярной массе (58,45 г/моль). Теоретически для приготовления 0,1 л 0,02 н. раствора требуется 58,45∙0,02∙0,1 = 0,1226 г. Тогда Т (NaCl) = 0,1226/100 = 0,001226 г/мл, а нормальная концентрация с (NaCl) = 0,001226∙1000/58,45 = 0/02097. Приготовление 100 мл приблизительно 0,02 н. раствора нитрата серебра. Н итрат серебра является дефицитным реактивом, и обычно растворы его имеют концентрацию не выше 0,05 н. Для данной работы вполне пригоден 0,02 н. раствор. При аргентометрическом титровании молярная масса эквивалента AgNO3 равна молярной массе, т.е. 169,9 г/моль. Поэтому 0,1 л 0,02 н. раствора должны содержать 169,9∙0,02∙0,1 = 0,3398 г AgNO3. Однако брать точно такую навеску не имеет смысла, так как продажный нитрат серебра всегда содержит примеси. Отвесьте на технохимических весах приблизительно 0,34-0,35 г нитрата серебра; перенесите навеску в мерную колбу вместимостью 100 мл, растворите ее в небольшом количестве воды и доведите объем водой до метки. Можно хранить раствор в колбе, обернув ее черной бумагой, но лучше перелить его в склянку темного стекла. На свету нитрат серебра разлагается с выведением свободного серебра. Стандартизация раствора нитрата серебра по хлориду натрия. Тщательно вымытую бюретку промойте раствором нитрата серебра и подготовьте ее к титрованию. Пипетку ополосните раствором хлорида натрия и перенесите 10,00 мл раствора в коническую колбу. Прилейте 2 капли насыщенного раствора хромата калия и осторожно, по каплям, титруйте раствором нитрата серебра при перемешивании. Добейтесь, чтобы переход желтой окраски смеси в красноватую произошел от одной избыточной капли нитрата серебра. Повторив титрование 2-3 раза, возьмите среднее из сходящихся отсчетов и вычислите нормальную концентрацию раствора нитрата серебра. Допустим, что на титрование 10,00 мл 0,02097 н. раствора хлорида натрия пошло в среднем 10,26 мл раствора нитрата серебра. Тогда с (AgNO3) ∙ 10,26 = 0,02097∙10,00; с (AgNO3) = 0,02097∙10,00/10,26 = 0,02043. Если предполагается определять содержание Cl- в образце, то вычисляют, кроме того, титр раствора нитрата серебра по хлору Т (AgNO3/Cl-) = 35,46 ∙ 0,02043/1000 = 0,0007244 г/мл, это означает, что 1 мл раствора нитрата серебра соответствует 0,0007244 г оттитрованного хлора.
5.5. Определение содержания хлора в образце по Мору Техника определения аналогична установлению нормальности раствора нитрата серебра. Содержание ионов Cl- нередко определяют в удобрениях и других сельскохозяйственных химикалиях. Ход определения. Возьмите пробирку с образцом анализируемого вещества, содержащим то или иное количество хлорида. Взвесьте ее, перенесите содержимое пробирки в мерную колбу вместимостью 10 мл. Снова взвесьте пробирку и по разности найдите величину навески. Растворите навеску вещества в воде, доведите объем раствора до метки, перемешайте. Отбирая пипеткой по 10,00 мл анализируемого раствора в коническую колбу, титруйте его раствором нитрата серебра в присутствии хромата калия. Из сходящихся отсчетов возьмите среднее и вычислите процентное содержание хлора в образце. Положим, навеска вещества составляла 0,1302 г, а на титрование 10,00 мл полученного раствора пошло в среднем 4,74 мл раствора нитрата серебра. Достаточно умножить эту величину на титр раствора нитрата серебра по хлору, чтобы найти массу Cl- в 10,00 мл анализируемой жидкости: 4,74∙0,0007244 = 0,003434 г. Но весь раствор содержит хлора в десять раз больше: 0,003434∙10 = 0,03434 г. Далее вычисляют массовую долю (%) хлора в образце
Использование титра раствора нитрата серебра по хлору особенно удобно при серийных определениях иона Cl- в образцах.
5.6. Приготовление стандартизированного раствора тиоцианата аммония Раствор NH4SCN или KSCN с точно известным титром нельзя приготовить растворением навески, так как эти соли очень гигроскопичны. Поэтому готовят раствор с приблизительной нормальной концентрацией и устанавливают ее по стандартизированному раствору нитрата серебра. Индикатором служит насыщенный раствор NH4Fe(SO4)2∙12H2O. Чтобы предупредить гидролиз соли Fe, к самому индикатору и к анализируемому раствору прибавляют перед титрованием 6 н. азотную кислоту. Приготовление 100 мл приблизительно 0,05 н. раствора тиоцианата аммония. Молярная масса эквивалента NH4SCN равна его молярной массе, т.е. 76,12 г/моль. Поэтому 0,1л 0,05н. раствора должны содержать 76,12∙0,05∙0,1 = 03806 г NH4SCN. Возьмите на аналитических весах навеску около 0,3-0,4 г, перенесите в колбу вместимостью 100 мл, растворите, доведите объем раствора водой до метки и перемешайте. Стандартизация раствора тиоцианата аммония по нитрату серебра. Подготовьте бюретку для титрования раствором NH4SCN. Ополосните пипетку раствором нитрата серебра и отмерьте 10,00 мл его в коническую колбу. Добавьте 1 мл раствора NH4Fe(SO4)2 (индикатор) и 3 мл 6 н. азотной кислоты. Медленно, при непрерывном взбалтывании, приливайте из бюретки раствор NH4SCN. Титрование прекратите после появления коричнево-розовой окраски [Fe(SCN)]2+, не исчезающей при энергичном встряхивании. Повторите титрование 2-3 раза, из сходящихся отсчетов возьмите среднее и вычислите нормальную концентрацию NH4SCN. Допустим, что на титрование 10,00 мл 0,02043 н. раствора нитрата серебра пошло в среднем 4,10 мл раствора NH4SCN. Тогда с (NH4SCN) ∙ 4,10 = 0,02043∙10,00; с (NH4SCN) = 0,02043∙10,00/4,10 = 0,04982.
5.7. Определение содержания хлора в образце по Фольгарду Галогены по Фольгарду определяют обратным титрованием остатка нитрата серебра раствором NH4SCN. Однако точное титрование возможно здесь лишь при условии, что будут приняты меры, предотвращающие (или замедляющие) реакцию между хлоридом серебра и избытком тиоцианата железа 3AgCl + Fe(SCN)3 = 3 AgSCN + FeCl3, при которой появляющаяся сначала окраска постепенно исчезает. Лучше всего отфильтровать осадок AgCl перед титрованием избытка нитрата серебра раствором NH4SCN. Но иногда вместо этого к раствору добавляют какую-нибудь органическую жидкость (нитробензол, тетрахлорид углерода и т.п.), не смешивающуюся с водой и как бы изолирующую осадок AgCl от избытка тиоцианата. Ход определения. Возьмите пробирку с образцом анализируемого вещества, содержащего хлорид натрия. Навеску вещества растворите в мерной колбе вместимостью 100 мл и доведите объем раствора водой до метки (концентрация хлорида в растворе должна быть не более 0,05 н.). Перенесите пипеткой 10,00 мл анализируемого раствора в коническую колбу, добавьте 3 мл 6 н. азотной кислоты и прилейте из бюретки заведомый избыток раствора AgNO3, например 18,00 мл. Затем осадок хлорида серебра отфильтруйте. Оттитруйте остаток нитрата серебра раствором NH4SCN, как описано в предыдущем параграфе. Повторив определение 2-3 раза, возьмите среднее. Если осадок хлорида серебра отфильтровали, то его следует промыть и присоединить промывные воды к фильтрату. Допустим, что навеска образца составила 0,2254 г. К 10,00 мл анализируемого раствора добавили 18,00 мл 0,02043 н. раствора нитрата серебра. На титрование избытка его пошло 5,78 мл 0,04982 н. раствора NH4SCN. Прежде всего вычислим, какой объем 0,02043 н. раствора нитрата серебра соответствует затраченным на титрование 5,78 мл 0,04982 н. раствора NH4SCN. V (AgNO3)∙0,02043 = 5,78∙0,04982; V (AgNO3)= 5,78∙0,04982/0,02043 = = 14,09 мл, следовательно, на осаждение иона Cl- пошло 18,00 – 14,09 = 3,91 мл 0,02043 н. раствора нитрата серебра. Отсюда легко найти нормальную концентрацию раствора хлорида натрия с (NaCl) ∙ 10,00 = 0,2043∙3,91; с (NaCl) = 0,2043∙3,91/10,00=0,007988. Поскольку молярная масса эквивалента хлора равна 35,46 г/моль, общая масса хлора в навеске составляет m = 0,007988∙35,46∙0,1 = 0,02832 г. Содержание хлора в массовых долях (%) составляет
По методу Фольгарда определяют также содержание ионов Br- и I-. При этом отфильтровывать осадки бромида или иодида серебра не требуется. Но нужно учитывать, что ион Fe3+ окисляет иодиды до свободного йода. Поэтому индикатор добавляют после осаждения всех ионов I- нитратом серебра.
Раздел 6. Комплексонометрическое титрование
|

 ) тиоцианатами
) тиоцианатами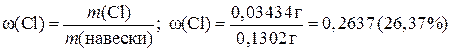 .
. .
.


