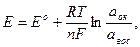Потенциометрия
Во всех электрохимических методах анализа используют электрохимическую ячейку, состоящую, как минимум, из двух электродов (индикаторного или рабочего электрода и электрода сравнения), погруженных в раствор электролита. Индикаторный электрод – это электрод, быстро реагирующий (легко поляризуемый) на изменение концентрации определяемого компонента в растворе, на котором протекает собственно электрохимическая реакция окисления или восстановления определяемого компонента: Меn+ + n е ↔ Meo или Меn+ + m е ↔ Men-m
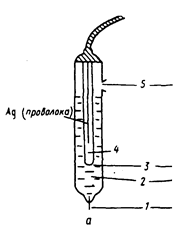
В зависимости от природы определяемого компонента используются те или иные типы индикаторных электродов, изготовленные из различных материалов. Потенциал индикаторного электрода измеряют относительно электрода сравнения. Электрод сравнения – это электрод, потенциал которого устойчив во времени и не меняется при прохождении небольшого тока в момент протекания каких-либо реакций в анализируемом растворе. Его также называют неполяризуемым электродом, то есть не реагирующим на изменение концентрации определяемого компонента в растворе. В качестве электродов сравнения чаще всего используют: -- хлоридсеребряный электрод, представляющий собой серебряную проволоку или пластинку, покрытую слоем соли AgCI и помещенную в насыщенный раствор KCI,рис.1; -- насыщенный каломельный электрод, состоящий из металлической ртути, каломели Hg2CI2 и насыщенного раствора KCI.
Рис. 1. Хлорид-серебряный электрод сравнения [Другов Ю. С. Экологическая аналитическая химия: учебное пособие – СПб.: Анатолия, 2002. – 464 с. Рис.IV.2, С.324] 1 – асбестовое волокно, обеспечивающее контакт с анализируемым раствором; 2 – внешний насыщенный раствор KCl; 3 – крошечное отверстие для контакта; 4 – внутренний насыщенный раствор KCl; проволока серебра покрыта солью AgCl; 5 – отверстие для налива раствора KCl
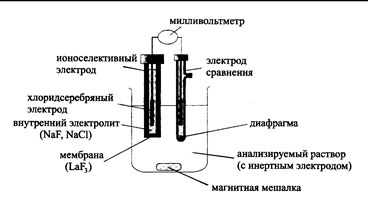
Потенциометрический метод химического анализа основан на измерении разности равновесных потенциалов индикаторного электрода и электрода сравнения, погруженных в анализируемый раствор, практически в отсутствии тока в цепи, рис.2.
Рис. 2. Схема потенциометрической ячейки с ионселективным электродом для определения фторидов [Отто М. Современные методы аналитической химии: учебник. – в 2-х томах – М.: Техносфера, 2006. – Т.1. – 544 с. – рис. 4.11, С.362]
Возникновение электродного потенциала связано с электродным процессом, протекающим на границе раздела индикаторный электрод – раствор электролита, содержащего окислительно-восстановительную пару: Меn+ + n е ↔ Meo или Ок + n е ↔Вос, где Ок и Вос – окисленная и восстановленная формы окислителя. В условиях установления динамического равновесия реакции окисления и восстановления потенциал индикаторного электрода называют равновесным. Реакции, протекающие на границе раздела электрод – раствор электролита, называются потенциалопределяющими, а ионы окисленной (Ок) и восстановленной (Вос) форм окислителя или восстановителя – потенциалопределяющими ионами. Согласно уравнению Нернста, потенциал обратимого индикаторного электрода зависит от активности потенциалопределяющих ионов:
где Ео – стандартный электродный потенциал окислительно-восстановительной пары окислителя или восстановителя, В, (табличное значение); R – универсальная газовая постоянная, равная8,312 Дж/(моль*К); T - абсолютная температура, К; n – число электронов, принимающих участие в электродной реакции; F – постояннаяФарадея,равная 96500 Кл/моль аок – активность окисленной формы окислителя (восстановителя) авос - активность восстановленной формы окислителя (восстановителя)
Методы потенциометрии подразделяются на -- рН-метрию, если измеряют концентрацию ионов водорода (величину рН) в растворе; -- редоксометрию, если измеряют концентрацию окислителей или восстановителей с помощью химически инертных платиновых или графитовых электродов; --ионометрию, если измеряют концентрацию ионов с помощью ион-селективных электродов.
|