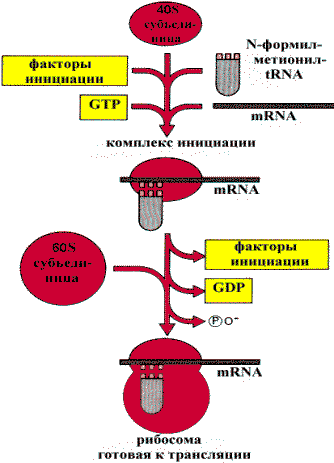
Аминоацил-tRNA -cинтетаза и расшифровка кодаНаиболее приспособлена к роли молекулы для расшифровки - tRNA, так как она может служить адаптером между триплетами нуклеотидов на mRNA и соответствующими им аминокислотами. Выполнение адаптерной функции становится возможным после связывания tRNA с определенной аминокислотой. Взаимное узнавание аминокислоты и tRNA происходит с помощью фермента - аминоацил-tRNA-синтетазы. Этот фермент узнает и связывает tRNA, а затем переносит аминокислотный остаток на 3’-ОН группу концевого аденозина, присоединяя ее сложно - эфирной связью: аа-tRNA-синтетазы + аминокислота + tRNA+ ATP à аминоацил-tRNA + АМР + Н4Р2О7 Взаимодействие аа-tRNA с кодоном mRNA обеспечивается тем, что в одной из петель молекулы tRNA имеется триплет нуклеотидов - антикодон, комплементарный определенному кодону mRNA. Рибосомы - это частицы, на которых происходит синтез белка. Рибосомы прокариот имеют две субъединицы: малую - 30S субъединицу, состоящую из одной молекулы RNA и 21 белка, и большую - 50S субъединицу, состоящую из двух молекул RNA и 34 разных белков. Рибосомы эукариот имеют очень похожую структуру, но несколько более крупные - 40S и 60S-субъединицы. Малая субъединица связывается с mRNA, а tRNA соединяется с обеими субъединицами. По мере синтеза белка последовательность кодонов mRNA считывается один раз в процессе движения рибосомы вдоль матрицы. Как только сайт инициации mRNA освобождается одной рибосомой, с ним может связываться другая. Поэтому одна mRNA часто может быть связана с несколькими рибосомами, образуя полирибосому. Инициация. До того как начнется синтез белка, формируется инициирующий комплекс, состоящий из малой и большой субъединиц рибосом, белковых факторов инициации и аминоацил - tRNA. Инициация запускается специфической последовательностью mRNA, содержащей кодон метионина. Элонгация. Большая субъединица рибосомы несет два рядом расположенных сайта связывания tRNA: один связывается с аминоацил -tRNA (сайт А), а другой - с пептидил - tRNA (сайт Р). Специфичность этих сайтов связывания определяется кодонами mRNA, комплементарными к антикодонам tRNA. Пептидильный остаток (или N-формилметионин на первой стадии) переносится на аминокислотный остаток tRNА, связанной с сайтом А, с образованием пептидил -tRNA в сайте А и «пустой» (свободной) tRNA в сайте Р. Это формирование пептидной связи катализируется рибосомальной пептидилтрансферазой.
Инициация трансляции у эукариот «Свободная» tRNAпокидает Р-сайт и новая пептидил -tRNA перемещается из А-сайта в освободившийся Р-сайт, а рибосома продвигается по mRNA, чтобы поместить в свободный А-сайт новый кодон. Этот этап называется транслокацией. Этапы инициации, связывания аа-tRNA и транслокации протекают с использованием энергии GTР. Терминация. Элонгация цепи продолжается до тех пор, пока рибосома не достигнет терминального кодона (UAG, UAA, UGA). Факторы терминации вызывают отделение «завершенного» полипептида от пептидил -tRNA в Р-сайте.
Элонгация Посттрансляционная модификация. Полипептиды, полученные в результате описанного процесса, спонтанно скручиваются, образуя вторичную и третичную конформацию. В клетках животных многие белки синтезируются в виде молекул-предшественников, требующих модификации для приобретения биологической активности. Например, инсулин синтезируется в виде проинсулина и представляет собой одноцепочечную молекулу. После удаления специфическими протеазами полипептидного сегмента он преобразуется в двухцепочечную молекулу с внутри- и межцепочечными дисульфидными мостиками. Присоединение простетической группы с образованием сложных белков и объединение протомеров в олигомерный белок также происходит после завершения трансляции. Известны многие другие посттрансляционные модификации белков. Например, ковалентные модификации, такие как ацетилирование, фосфорилирование и гликозилирование. Кроме того, может происходить модификация аминокислотных остатков, например превращение пролина и лизина в оксипролин и оксилизин в коллагенах, иодирование тирозина в тирео- глобулине и т.д.
|