Основные типы задач и методы их решенияКлассификация 1. Определение теплоемкостей газа или смеси газов по заданной массе, молекулярной массе и числу степеней свободы. Метод решения. Используются: а) определение количества теплоты; б) связь между молярной и удельной теплоемкостями газа; в) формулы для определения молярных теплоемкостей Ср и СV через число степеней свободы. 2. Определение количества тепла, полученного газом, работы расширения газа и изменения его внутренней энергии в заданном процессе перехода. Метод решения. Использование первого начала термодинамики, выражений для определения изменения внутренней энергии, работы расширения газа и количества теплоты для заданного процесса перехода, уравнений состояния идеального газа и процессов перехода. Примеры Задача 1. Определить удельную теплоемкость при V = const газовой смеси, состоящей из 4 кг неона и 1 кг водорода.
Решение По определению, количество теплоты
где сV – удельная теплоемкость рассматриваемой смеси идеальных газов. С другой стороны, выражение для
где
Откуда
Удельные теплоемкости идеальных газов
Учитывая эти выражения, окончательно получаем
В рассмотренном примере: неон – одноатомный газ, следовательно,
Задача 2. Найти, чему равна степень диссоциации азота, если известно, что отношение Решение. Степень диссоциации, то есть часть молекул газа, диссоциированных на атомы, обозначим через a. Диссоциированный азот будет представлять собой одноатомный газ (
а для недиссоциированного азота
Для смеси диссоциированного и недиссоциированного азота, имеем
где Аналогичное выражение получим для удельной теплоемкости смеси при постоянном давлении
Взяв отношение теплоемкостей
после несложных алгебраических преобразований, получим
Задача 3. Один килограмм кислорода нагревается от 300 К до 350 К различными способами: а) при p = const, б) при V = const, в) при Решение а) Для изобарического процесса (p = const) следует
Согласно первому началу термодинамики
б) Для изохорического процесса (V = const)
Отсюда получим, что
в) Для адиабатического процесса (рVg = const) первое начало термодинамики запишется так:
Таким образом, в любом процессе при нагревании газа от Т1 до Т2 изменение внутренней энергии одинаково и равно
Задача 4. Киломоль идеального газа, имеющего первоначально температуру Т1 = 290 К, расширяется изобарически до тех пор, пока его объем не возрастает в 2 раза. Затем газ охлаждается изохорически до первоначальной температуры Т1. Определить: а) приращение внутренней энергии газа; б) работу, совершаемую газом; в) количество полученного газом тепла. Решение
Прямая 2-3 – изохора. На ней идет охлаждение газа от Т2 до Т3 = Т1 с соответствующим уменьшением давления. В этом процессе идет уменьшение внутренней энергии целиком за счет теплоты Полное изменение внутренней энергии
Работа, совершаемая газом при переходе из состояния 1 в состояние 3, определяется работой на участке 1-2 (На участке 2-3 А = 0) и равна
С учетом уравнения Менделеева-Клапейрона и того, что
Для одного киломоля газа
Количество полученного газом тепла в процессе перехода 1-2-3 определится алгебраической суммой количеств теплоты
По первому началу термодинамики
С учетом того, что
Задача 5. Атмосферный воздух в объеме 10 л подвергается в двигателе дизеля 12- кратному адиабатическому сжатию. Начальная температура 10° С. Определить конечное давление, конечную температуру и работу сжатия. Решение Допуская, что атмосферный воздух состоит в основном из кислорода (О2) и азота (N2), можно считать его двухатомным газом, для которого
Конечное давление Р2 найдем из уравнения адиабаты
Откуда
Подставив числовые значения, найдем
Из уравнений Менделеева-Клапейрона для двух состояний газа
с учетом уравнения адиабаты, определим конечную температуру
Работу адиабатического сжатия в данной задаче можно подсчитать двумя способами. Исходя из определения работы при адиабатическом сжатии
Подставляя числовые значения, получим А = -4,8×103 Дж. С другой стороны, используя первое начало термодинамики для адиабатическое процесса
получим где Очевидно, что после подстановки числовых значений, получим ту же величину работы А = - 4,8×103 Дж.
|

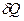 , сообщенное смеси, равно
, сообщенное смеси, равно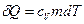 ,
,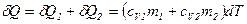 ,
,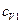 ,
, 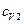 ,
, 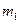 и
и 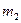 - удельные теплоемкости и массы неона и водорода соответственно. Приравнивая правые части этих выражений, и сокращая на dT, получим
- удельные теплоемкости и массы неона и водорода соответственно. Приравнивая правые части этих выражений, и сокращая на dT, получим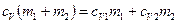 .
.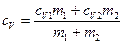 .
.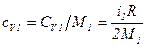 ,
,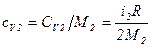 .
.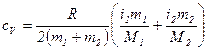 .
.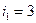 ; водород – двухатомный газ,
; водород – двухатомный газ, 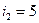 . Подстановка числовых значений в формулу дает
. Подстановка числовых значений в формулу дает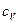 =2,58 ×103 Дж/кг×К.
=2,58 ×103 Дж/кг×К.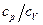 для него равно 1,47.
для него равно 1,47.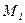 =14 кг/кмоль) и соответственно обладать тремя степенями свободы, т.е.
=14 кг/кмоль) и соответственно обладать тремя степенями свободы, т.е. 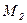 =28 кг/кмоль), как двухатомный газ, будет обладать пятью степенями свободы,
=28 кг/кмоль), как двухатомный газ, будет обладать пятью степенями свободы, 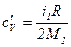 ;
; 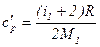 ,
, ;
;  .
.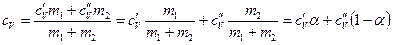 ,
,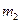 - массы соответственно диссоциированного и недиссоциированного азота.
- массы соответственно диссоциированного и недиссоциированного азота.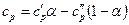 .
. ,
,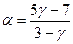 =23 %.
=23 %.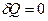 . Проверить положение о том, что изменение внутренней энергии идеального газа не зависит от процесса перехода. Определить изменение внутренней энергии кислорода при его нагревании.
. Проверить положение о том, что изменение внутренней энергии идеального газа не зависит от процесса перехода. Определить изменение внутренней энергии кислорода при его нагревании.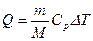 и
и 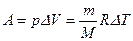 .
.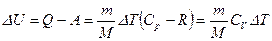 .
.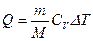 , А = 0.
, А = 0.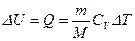 .
.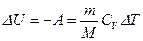 .
.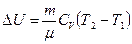 =3,2×103 Дж.
=3,2×103 Дж. Представим переход газа из одного состояния в другое графически в системе координат рV (рис.1). Прямая 1-2 – изобара. На ней идет повышение температуры, следовательно, увеличивается внутренняя энергия газа. Кроме того, газ, расширяясь (V2 > V1), совершает работу, которая представлена на графике заштрихованной площадью V112V2. Увеличить свою внутреннюю энергию и одновременно произвести работу газ может только за счет теплоты
Представим переход газа из одного состояния в другое графически в системе координат рV (рис.1). Прямая 1-2 – изобара. На ней идет повышение температуры, следовательно, увеличивается внутренняя энергия газа. Кроме того, газ, расширяясь (V2 > V1), совершает работу, которая представлена на графике заштрихованной площадью V112V2. Увеличить свою внутреннюю энергию и одновременно произвести работу газ может только за счет теплоты 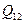 , полученной от внешнего источника.
, полученной от внешнего источника.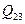 , отданной газом окружающей среде, т.к. внешние силы не совершают работы над газом
, отданной газом окружающей среде, т.к. внешние силы не совершают работы над газом 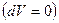 .
.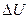 складывается из изменения энергии на участке 1-2 и изменения энергии на участке 2-3. Поскольку в данном случае начальная и конечная температуры совпадают, т.е. Т1 = Т2 и
складывается из изменения энергии на участке 1-2 и изменения энергии на участке 2-3. Поскольку в данном случае начальная и конечная температуры совпадают, т.е. Т1 = Т2 и 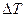 = 0 и, следовательно,
= 0 и, следовательно,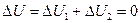 .
.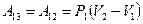 .
.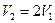 имеем
имеем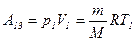 .
.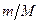 =1 и окончательно
=1 и окончательно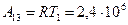 Дж.
Дж. =
= 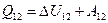 и
и 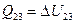 , (А13 = 0).
, (А13 = 0).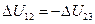 , получим
, получим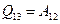 =2,4×106 Дж.
=2,4×106 Дж.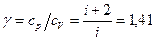 .
.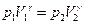 .
.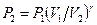 .
.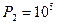 (12)1,41 Па = 32,5×105 Па.
(12)1,41 Па = 32,5×105 Па.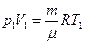 ,
, 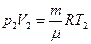
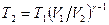 =763 К.
=763 К. .
.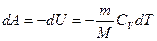 ,
,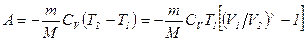 ,
,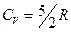 .
.


