Энергетика химических процессов. Пример 1. Определите стандартную энтальпию образования ацетилена, если при сгорании 11,2 л его выделилось 401 кДж тепла.
Пример 1. Определите стандартную энтальпию образования ацетилена, если при сгорании 11,2 л его выделилось 401 кДж тепла.
Решение. Термохимическими называются уравнения реакций, в которых около символов химических соединений указываются их агрегатное состояние (ж – жидкое, к – кристаллическое, г – газообразное), а также численное значение теплового эффекта реакции. Тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы ΔH. При экзотермических реакциях теплота выделяется ΔH < 0. При эндотермических реакциях теплота поглощается, энергосодержание системы увеличивается и ΔH > 0. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования одного моля этого соединения из простых веществ, взятых в их устойчивых состояниях, при стандартных условиях t = 25°C (298 K), P = 1,013·105 Па, и обозначают В основе термохимических расчетов лежит закон Гесса: тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
1. Определяем тепловой эффект химической реакции.
а) находим количество моль C2H2
б) 0,5 моль C2H2 – (-401 кДж) 1 моль C2H2 – x
2. Определяем стандартную энтальпию образования C2H2 –
Стандартные энтальпии образования определяем из табл. 1:
Энтальпии образования простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, приняты равными нулю (
= 2·(-393,51) + 1·(-241,83) – (-802) – 0 = 226
Ответ:
Пример 2. Что имеет большую энтропию: один моль кристаллического вещества или один моль его паров при той же температуре?
Решение. Энтропия есть мера неупорядоченного состояния вещества. В кристалле частицы (атомы, ионы) имеют упорядоченное расположение и могут находиться лишь в некоторых точках пространства, а для газа таких ограничений нет. Один моль газа имеет гораздо больший объем, чем один моль кристалла, и возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия моля паров вещества больше энтропии моля его кристаллов при одинаковой температуре.
Пример 3. На основании стандартных энтальпий образования (табл. 1) и абсолютных стандартных энтропий веществ (табл. 2) вычислите
Решение. Изменение энергии Гиббса в химической реакции при температуре (T) можно вычислить по уравнению
ΔG = ΔH – TΔS, где ΔG – изобарно изотермический потенциал (энергия Гиббса). ΔS – изменение энтропии в системе.
Изменение энтропии в системе в результате химической реакции равно сумме стандартных энтропий продуктов реакции за вычетом суммы стандартных энтропий исходных веществ с учетом коэффициентов перед формулой этих веществ в уравнении реакции:
Стандартной энтропией вещества называется энтропия одного моля вещества при стандартных условиях. Значения
Тепловой эффект химической реакции
= (-393,51 + 0) – (-110,5 + (-285,8)) = 2,85 кДж
Изменение энтропии в химической реакции
= (213,5 + 130,6) – (197,6 + 70,1) = 76,39
Изменение энергии Гиббса в химической реакции
ΔG = ΔH – TΔS; T = 298 К При расчете ΔG величину энтропии следует умножить на 10-3, так как ΔH выражается в кДж, а ΔS в
ΔG = 2,85 – 298·(76,39)·10-3 = -19,91 кДж
Знак изменения свободной энергии Гиббса определяет направление химической реакции. Самопроизвольно протекают процессы, идущие в сторону уменьшения ΔG и чем более отрицательные значения имеет ΔG, тем сильнее стремление к протеканию реакции. В примере ΔG < 0, следовательно, в стандартных условиях самопроизвольное протекание данной реакции в прямом направлении возможно.
Пример 4. Восстановление Fe2O3 водородом протекает по уравнению
Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(г); ΔH = 96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии ΔS = 0,1387
Решение. Вычисляем ΔG0 реакции:
ΔG = ΔH – TΔS = 96,61 – 298·0,1387 = +55,28 кДж.
Так как ΔG > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой ΔG = 0:
ΔH = TΔS;
Следовательно, при температуре 696,5К начнется реакция восстановления Fe2O3.
|

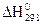 , значения
, значения  ; ΔHх.р.
; ΔHх.р. , где
, где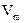 – молярный объем,
– молярный объем, 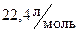 ;
; моль
моль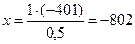 кДж (ΔHх.р.)
кДж (ΔHх.р.)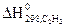 реакции. Для этого используем следствие из закона Гесса: тепловой эффект химической реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы образования исходных веществ с учетом коэффициентов, стоящих перед формулами этих веществ в уравнении реакции.
реакции. Для этого используем следствие из закона Гесса: тепловой эффект химической реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы образования исходных веществ с учетом коэффициентов, стоящих перед формулами этих веществ в уравнении реакции.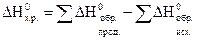


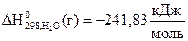
 ), следовательно,
), следовательно,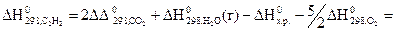
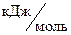
 = 226
= 226  изменение энергии Гиббса реакции, протекающей по уравнению:
изменение энергии Гиббса реакции, протекающей по уравнению: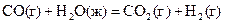
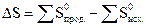
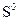 некоторых веществ приведены в табл. 2. Выпишем из табл. 1 и 2 значения стандартных энтальпий образования и энтропий веществ:
некоторых веществ приведены в табл. 2. Выпишем из табл. 1 и 2 значения стандартных энтальпий образования и энтропий веществ: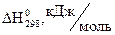
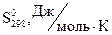
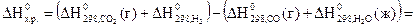
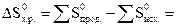
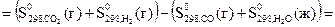
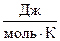
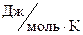 .
.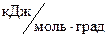 ? При какой температуре начнется восстановление Fe2O3?
? При какой температуре начнется восстановление Fe2O3? .
.


