Взаимозависимые параметры состояния газовЕсли энергия притяжения между молекулами меньше их кинетической энергии, то совокупность таких молекул будет существовать в виде газа. Индивидуальное вещество в газообразном состоянии характеризуется следующими величинами: Р – давлением; Т или t – температурой, измеряемой в Кельвина или градусах Цельсия; J - объемом, m – массой всего газа; М – грамм-молекулярной массой. Газовые законы устанавливают взаимосвязь между этими величинами. Вначале были установлены законы, справедливые для постоянной массы данного газа (т.е. m = const и М = const), и, кроме того, одна из оставшихся величин (Р, J, Т) также поддерживается постоянной. 1. Т = const (изотермический процесс). Взаимосвязь между изменением Р и J выражается законом Бойля-Мариотта: Р1J1 = Р2J2 или РJ = const. 2. Р = const (изобарический процесс). Взаимосвязь между изменением J и t выражается законом Гей-Люссака: Jt = Jo (1 + at), где a – коэффициент удельного объемного расширения, равный для всех газов a = 1/273 град-1. Если это значение подставить в уравнение и температуру выразить в шкале Кельвина, то закон Гей-Люссака запишется так:
3. J = const (изохорический процесс). Взаимосвязь между Р и t выражается законом Шарля: Рt = Po (1 + at) где a = 1/273 град-1. В более удобной форме можно записать так:
На основе трех частных законов можно вывести объединенный газовый закон:
После того как было установлено экспериментально, что грамм-молекула любого газа при нормальных условиях (Р = 1 атм = 1, 013× 105 н/м2 = 101325 Па; t = 0 оС или Т = 273 К) занимает объем – 22, 4 л (кг – молекула – 22, 4× 10-3 м3), объединенный газовый закон можно записать так: PJ = RT, где R - универсальная газовая постоянная. Численное значение R зависит от единиц измерения величин, ее определяющих: R = 62360 мм.рт.ст./К× моль = 0, 082 л× атм/К× моль = 8, 314 Па× м3/К× моль = = 8, 314 Дж/К× моль = 8, 414× 103 кДж/К× моль = 1, 987 кал/к× моль. Уравнение PJ = nRT, где n = m/M, называется уравнением Менделеева-Клапейрона, оно выражает взаимосвязь между всеми величинами, характеризующими газ, а поэтому является наиболее общим в приближении к модели идеального газа.
|

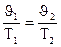 или
или 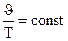 .
.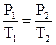 или
или 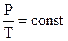 .
.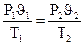 или
или 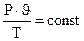 .
.


