Электродные реакции и потенциалы разряда ионов
Анализируя данные табл. 2.2.1 можно сделать вывод, что при стандартных условиях (электрод Pt) на катоде наиболее вероятным является выделение водорода, а на аноде – кислорода в результате разрядки гидроксоаниона. Выделение металлического натрия из водного раствора на твердом электроде невозможно, поскольку эта реакция (табл. 2.2.1, реакция 3) имеет большой отрицательный потенциал. В кислой среде возможно совместное выделение хлора и кислорода, т.к. их потенциалы электродных реакций близки между собой. В условиях, отличных от стандартных, электродный потенциал называют равновесным (ЕP) и рассчитывают по уравнению Нернста:
где ЕО – величина стандартного электродного потенциала, В; R – газовая постоянная, равная 8, 315 Дж/моль∙ K; Т – температура, К; n – число электронов, участвующих в электродной реакции; F – число Фарадея, равное 96500 кулонов (или 26, 8 А× ч) на моль;
Второе слагаемое уравнения (2.2.4) учитывает отклонение от стандартных условий температуры и активности ионов. Равновесный потенциал электрода характеризует термодинамическое равновесие, которое устанавливается на электроде без протекания тока. Таким образом, термодинамический анализ электрохимических потенциалов можно осуществлять на основании величины равновесных электродных потенциалов. В случае выделения на катоде водорода (табл. 2.2.1, реакция 4) равновесный электродный потенциал равен:
При выделении хлора на аноде (табл. 1, реакция 1):
Из уравнений (2.2.5-2.2.6) следует, что равновесие электродных реакций, так же, как и в других ХТП, можно смещать в сторону исходных или конечных продуктов, изменяя температуру, активность ионов (Н3О+ или Cl-) исходных реагентов и парциальные давления ( Кроме того, практические, то есть реализующиеся в условиях электролиза потенциалы разряда ионов всегда выше, чем рассчитанные по уравнению Нернста. Практический потенциал (Е) отличается от равновесного на величину перенапряжения (см. Кинетику электродных процессов):
где e - потенциал перенапряжения, соответственно, на аноде или катоде. Таким образом, практический потенциал разряда иона равен алгебраической сумме величин равновесного потенциала и перенапряжения (потенциал анода становится более положительным, а потенциал катода – более отрицательным). Следует отметить, что в реальных условиях на одном и том же электроде могут протекать несколько параллельных электродных реакций. Так, при электролизе раствора хлорида натрия на аноде могут одновременно выделяться хлор и кислород. Как видно из табл. 2.2.1 согласно значениям равновесных потенциалов на аноде прежде всего должно происходить выделение кислорода (реакция 2), так как равновесный электродный потенциал данной реакции меньше, чем равновесный потенциал выделения хлора. Варьируя условия электролиза (температуру, концентрацию хлорид-анионов, материал анода) можно, меняя перенапряжение, ускорить процесс выделения хлора по сравнению с выделением кислорода, чего и добиваются в реальных условиях (практический потенциал выделения кислорода становится больше соответствующей величины для хлора).
Одновременно с основной реакцией в объеме электролита и на электродах могут протекать вторичные побочные реакции. В анодном пространстве выделяющийся хлор может растворяться в электролите и взаимодействовать с водой, образуя соляную и слабо диссоциирующую хлорноватистую кислоты:
Cl2 + H2O «HCl + HClO (2.2.7)
В случае проникновения гидроксид-ионов из катодного пространства в анодное образуются хорошо диссоциирующие хлорид и гипохлорит натрия:
HClO + NaOH «NaClO + H2O (2.2.8)
HCl + NaOH = NaCl + H2O (2.2.9)
Таким образом, суммарная реакция образования гипохлорита натрия выглядит так:
Cl2 + 2NaOH = NaClO + NaCl + H2O (2.2.10)
Кроме того, гипохлорит натрия может диспропорционировать при повышенных температурах с образованием хлората натрия:
3NaClO «NaClO3 + 2NaCl (2.2.11)
Образующийся кислород может взаимодействовать с графитовым анодом:
С + О2 = СО2 (2.2.12)
Могут протекать и другие побочные электродные процессы. Например, восстановление гипохлорит-ионов на катоде (2.2.13) и их окисление на аноде (2.2.14):
К ½ ClO-+2H+ + 2e-= Cl-+ H2O, (2.2.13) A ½ 6ClO-+ 3H2О - 6e-= 2ClO3 - + 4Cl- +1, 5O2 +6H+ (2.2.14)
Доля побочных электродных реакций в оптимальных условиях проведения процесса невелика (3-5%), но эти реакции могут существенно снижать качество и выход основных продуктов при нарушении технологических режимов, а также вызывают разрушение диафрагмы. Таким образом, электрохимическое равновесие, устанавливающееся на электроде, зависит от концентраций исходных и конечных продуктов, температуры, давления и может быть смещено в ту или другую сторону. В отличие от других ХТП, равновесие электродной реакции можно смещать, прикладывая ДОПОЛНИТЕЛЬНОЕ напряжение с помощью внешнего источника постоянного тока.
|

 = - 0, 83 В
= - 0, 83 В
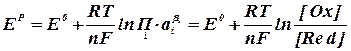 (2.2.4)
(2.2.4)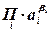 – произведение активностей или концентраций (давлений) веществ, участвующих в электродной реакции, равных стехиометрическим коэффициентам (с учетом знака
– произведение активностей или концентраций (давлений) веществ, участвующих в электродной реакции, равных стехиометрическим коэффициентам (с учетом знака 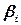 ), по форме совпадающее с константой равновесия;
), по форме совпадающее с константой равновесия;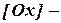 концентрация окисленной формы вещества;
концентрация окисленной формы вещества; концентрация восстановленной формы вещества
концентрация восстановленной формы вещества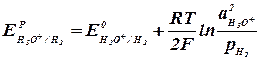 (2.2.5)
(2.2.5)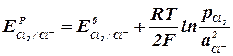 (2.2.6)
(2.2.6)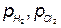 ) конечных продуктов. При этом может измениться последовательность в ряду потенциалов.
) конечных продуктов. При этом может измениться последовательность в ряду потенциалов.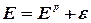 ,
,


