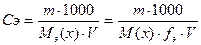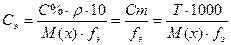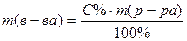Способы выражения концентрации растворовМолярная концентрация раствора С m – величина, показывающая сколько молей вещества находится в 1 литре раствора. Единица измерения - моль/л
n(х) – количество вещества (моль) m – масса растворенного вещества (г) М(х) – молярная масса растворенного вещества (г/моль) V – объем раствора (л) Если объем раствора дан в миллилитрах (мл), то
Например, Сm = 0, 5 моль/л означает, что в 1 литре раствора находится 0, 5 моль растворенного вещества. Молярная концентрация эквивалента Сэ - величина, показывающая, сколько моль эквивалента находится в 1 литре раствора. Единица измерения моль-экв./л
nэ(х) - количество вещества эквивалента (моль-экв.):
Эквивалент – некая реальная или условная частица, которая может присоединять или высвобождать один ион водорода в кислотно-основных реакциях или один электрон в окислительно-восстановительных реакциях m – масса растворенного вещества (г) Мэ(х) – молярная масса эквивалента (г/моль-экв.). Мэ(х) = М(х)· fэ Фактор эквивалентности f э - величина безразмерная, рассчитывается для разных классов соединений по следующим формулам. Для кислот: Например: fэ(H2SO4) = Для оснований: fэ(основания) = Например: fэ(KOH) = 1; fэ[Al(OH)3] = Для солей: fэ(соли) = Например, fэ (K2SO4)= Если объем раствора дан в миллилитрах (мл), то
Например, Сэ= 0, 5 моль-экв/л означает, что в 1 л раствора находится 0, 5 моль эквивалента растворенного вещества. Ранее данный способ выражения концентрации назывался нормальностью раствора. Массовая доля (процентная концентрация) С% или ω – величина, показывающая, сколько граммов вещества находится в 100 г раствора. Единицы измерения: % или доли единицы.
m(в-ва) – масса растворенного вещества (г, кг) m(р-ра) – масса раствора (кг, г); m(р-ра) = V·ρ V – объем раствора (л, мл) ρ – плотность раствора (г/мл, кг/л) Например, С% = 6%. Это означает, что в 100 г раствора находится 6 г растворенного вещества (6г вещества и 94г воды). Титр раствора Т – величина, показывающая, какая масса вещества находится в 1 миллилитре раствора.
m(в-ва) – масса растворенного вещества (г) V(р-ра)- объем раствора (мл) Например, Т= 0.0063 г/мл означает, что в 1 мл раствора растворено 0, 0063 г вещества. Миллиграмм-процент (мг%) – величина, показывающая, сколько миллиграммов вещества находится в 100 г или 100 мл физиологического раствора (ρ = 1г/мл) Данный способ выражения концентрации используется в медицинской практике и отличается от процентной концентрации только единицей измерения массы растворенного вещества. Все виды концентрации пропорциональны друг другу, следовательно, можно от одного способа выражения концентрации перейти к другому.
Обучающая задача. 0.85% раствор хлорида натрия является физиологическим раствором. Найдите массу воды и соли, необходимые для приготовления 500 мл физиологического раствора (ρ =1.005 г/мл). Определите Сm, Сэ, Т полученного раствора. Решение: 1) Найдем массу раствора, который необходимо приготовить. m (р-ра) = V·ρ = 500·1, 005 = 502, 5 г 2) Найдем массу хлорида натрия, необходимого для приготовления 502, 5г раствора.
Выразим из формулы массу растворенного вещества.
m (в-ва) = 3) Найдем массу воды, необходимую для приготовления раствора m (Н2О) = 502, 5 – 4, 27 = 498, 23 г Задачи для самостоятельного решения 1. Найдите массу CuSO4 в 2, 2 л раствора с См (CuSO4) = 0, 2 моль/л. Какова С% данного раствора, если его ρ = 1, 05 г/мл? Ответ: m(CuSO4) = 70, 4 г; С% = 3, 05% 2. Сколько граммов йода и миллилитров спирта (ρ = 0, 8 г/мл) необходимо для приготовления 200 г 5% йодной настойки? Ответ: 10 г йода, 237 мл спирта 3. Сернокислый цинк ZnSO4 применяется в виде 0, 25 % -ного раствора в воде как глазные капли. Сколько нужно добавить воды к 25 г 2%-ного раствора, чтобы приготовить глазные капли? Ответ: 175 г воды 4. Сколько мл. 36%-ного раствора HCl c ρ = 1, 18 г/мл нужно взять, чтобы приготовить 200 мл раствора с Сэ = 0, 1 моль-экв/л. Ответ: 1, 72 мл 5. Какой объем серной кислоты 34% раствора (ρ =1, 25 г/см3) нужно взять, чтобы приготовить 500 мл раствора с Т = 0, 004901 г/мл? Ответ: V = 5, 7 мл
Тесты задания для самопроверки
|









 ; fэ(НCl) = 1
; fэ(НCl) = 1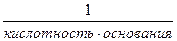


 ; fэ [Fe2(SO4)3] =
; fэ [Fe2(SO4)3] =