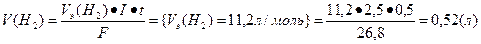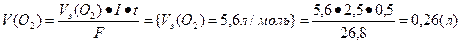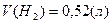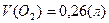Типовая задача. Через раствор сульфата натрия Na2SO4 пропустили ток силой 2,5 А в течение 30 минутЧерез раствор сульфата натрия Na2SO4 пропустили ток силой 2, 5 А в течение 30 минут. Написать уравнения электродных процессов, происходящих при электролизе (инертный анод) и указать какие продукты и в каком количестве были получены. Решение. 1. Описываем электродные процессы. Катод. На этом электроде осуществляется процесс восстановления. Катод при электролизе заряжен отрицательно, поэтому при наложении разницы потенциалов в пространство у катода будут поступать катионы натрия Na+, помимо них там будут присутствовать молекулы растворителя – воды.
Если система, в которой проводят электролиз, содержит несколько окислителей, то на катоде будет восстанавливаться тот, у которого значение электродного потенциала больше. Воспользовавшись данными таблицы П.2, в приложении сравним электродные потенциалы возможных окислителей: Na+ + e- = Na φ 0= - 2, 71 B 2H2O + 2 e- = H2 + 2OH− φ 0= - 0, 41B Потенциал первой системы значительно отрицательнее потенциала второй, поэтому на катоде будет происходить восстановление молекул воды с образованием водорода. Помимо этого, образовавшиеся гидроксид - ионы будут ассоциироваться с накопившимися в пространстве у катода катионами натрия. Анод. На этом электроде идет процесс окисления. Анод при электролизе заряжен положительно, поэтому в ходе процесса в пространство у анода будут поступать сульфат - ионы SO42− , помимо них там будут присутствовать молекулы растворителя – воды. На аноде окисляется тот из восстановителей, стандартный электродный потенциал которого наименьший. Сравним электродные потенциалы, которые характеризуют две рассматриваемые системы: 2H2O = O2 ↑ + 4H+ + 4e- φ 0=1, 23 B 2SO42− = S2O82- + 2e- φ 0=2, 01 B Исходя из этих значений, делаем вывод, что на аноде будет происходить окисление воды с образованием кислорода. Образующиеся протоны водорода будут ассоциироваться с накопившимися в пространстве у анода сульфат - ионами. Таким образом, процессы, протекающие на электродах при электролизе раствора сульфата натрия, будут описываться следующими уравнениями:
Записываем суммарное уравнение электролиза: 2Na++SO42− + 6 H2O = 2H2 ↑ + O2 ↑ + 4Na+ + 4OH− + 4H+ + 2SO42− 2. Количественное описание процесса электролиза выполняем с использованием математического выражения закона Фарадея:
m и V – масса и объем образовавшегося или подвергшегося превращению вещества, г, л; mЭ и Vэ – эквивалентная масса и эквивалентный объем этого вещества, г/моль, л/моль; I – сила тока при электролизе, А; t – время электролиза, с; F – постоянная Фарадея, 96500 Кл/моль или 26, 8 А·ч.
Основными продуктами электролиза являются кислород и водород; определим объемы поученных газов.
Ответ:
Варианты заданий Таблица 11
|

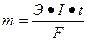 или
или 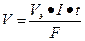 , где
, где