Ключ к правильным ответам
| Номер вопроса
| Ответ
| Баллы
| | вариант 1
| вариант 2
| | 1.
| в
| в
|
| | 2.
| а
| в
|
| | 3.
| б
| а
|
| | 4.
| б, в
| б, в
|
| | 5.
| …С2H8 +2NaCl
| CH3 – CH2Cl
|
| | 6.
| C2H6  C2H4+H2
C2H4 + Н2О C2H4+H2
C2H4 + Н2О 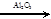 С2Н5ОН С2Н5ОН
| C2H4+H2 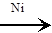 C2H6
C2H6+Cl2® C2H5Cl + HCl C2H6
C2H6+Cl2® C2H5Cl + HCl
|
| | 7.
| а, в
| а, в
|
| | 8.
| …C6H6
| …СН3СНО
|
| | 9.
| С2Н4  С2Н2 + Н2
С2Н2 + С2Н4 С2Н2 + Н2
С2Н2 + С2Н4  CHº C –CH=CH2 CHº C –CH=CH2
| С2Н2+Н2 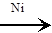 С2Н4
С2Н4 С2Н4
С2Н4  СН2ОН– СН2ОН СН2ОН– СН2ОН
|
| | 10.
| а
| а
|
| | 11.
| б, г
| б, г
|
| | 12.
| б
| б
|
| | 13.
| …углеводороды, имеющие в молекуле одну двойную связь.
| …углеводороды, имеющие в молекуле одну тройную связь.
|
| | 14.
| в
| б
|
| | 15.
| в
| в
|
| | 16.
| а, в
| а, в
|
| | 17.
| С3Н4 + 2HCl ® C3H6Cl2
C3H6Cl2 + Zn ® C3H6
C3H6 + H2O  C3H8O C3H8O
| C2H4+H2 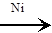 C2H6
C2H6+Cl2® C2H5Cl + HCl
C2H5Сl + CH3Cl + 2Na ® C3H8 + 2NaCl C2H6
C2H6+Cl2® C2H5Cl + HCl
C2H5Сl + CH3Cl + 2Na ® C3H8 + 2NaCl
|
| | 18.
| C2H6 + Cl2 ® C2H5Cl + НСl
C2H5Cl + КОН(сп. р-р) ® С2Н5ОН + KCl
2C2H5ОН  CH2=CH–CH=CH2 + 2H2O CH2=CH–CH=CH2 + 2H2O
| C2H4 + HCl ® C2H5Cl
2C2H5Cl + 2Na ® C4H10 + 2NaCl
C4H10 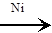 CHº C–CH2–CH3 + 2H2 CHº C–CH2–CH3 + 2H2
|
| | 19.
| CH2=CH– CH=CH2 + Br2 ® CH2Br– CH=CH– CH2Br
или
CH2=CH– CH=CH2 + 2Br2 ® CH2Br– CHВr-CHBr– CH2Br
| CHº C–CH2–CH3 + Br2® CHBr= CBr– CH2– CH3
или
CHº C–CH2–CH3 + 2Br2® CHBr2- CBr2– CH2– CH3
|
| | 20.
| C2H4+H2O®C2H6O
C2H6O  C2H6
C2H6 + Cl2 ® C2H5Cl
C2H5Cl + 2Na ® C4H10 + 2NaCl
C4H10 + 2Br2®C4H8Br2 + 2HBr C2H6
C2H6 + Cl2 ® C2H5Cl
C2H5Cl + 2Na ® C4H10 + 2NaCl
C4H10 + 2Br2®C4H8Br2 + 2HBr
| C2H4 + HCl®C2H5Cl
C2H5Cl + КОН(сп. р-р) ® С2Н5ОН + KCl
C2H5ОН  C2H4 + H2O
C2H4 + Br2 ® C2H4Br2 C2H4 + H2O
C2H4 + Br2 ® C2H4Br2
|
| | 21.
| CHº C–CH2–CH3 + 2HBr ® CH3– CHBr2– CH2–CH3
CH3– CHBr2– CH2–CH3
+ 2KOH (сп. р-р) ® CH3- Cº C-CH3 + 2KBr
| CH2=CH–CH2–CH3 + HBr ® CH3– CH2Br– CH2–CH3
CH3– CH2Br– CH2–CH3
+ KOH (сп. р-р) ® CH3- CH=CH-CH3 + KBr
|
| | 22.
| 2CH4  C2H2+H2
3C2H2 C2H2+H2
3C2H2  C6H6 C6H6
| 3C2H2  C6H6
C6H6 + 3H2 C6H6
C6H6 + 3H2
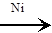 C6H12 C6H12
|
| | 23.
| СНº СН + С2Н2+Н2 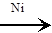 С2Н4
C2H4 + Н2О С2Н4
C2H4 + Н2О 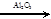 С2Н5ОН
2C2H5ОН С2Н5ОН
2C2H5ОН  CH2=CH–CH=CH2 + 2H2O
CH2=CH–CH=CH2 + Сl2 CH2=CH–CH=CH2 + 2H2O
CH2=CH–CH=CH2 + Сl2  CH2=CCl–CH=CH2 + НСl CH2=CCl–CH=CH2 + НСl
| 3C6H10 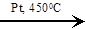 2C6H12 + C6H6
C6H6 + CН3Сl ® C6H5CH3 + HCl 2C6H12 + C6H6
C6H6 + CН3Сl ® C6H5CH3 + HCl
|
| |
|
| Итого
|
| | Менее 20 баллов - «2»
21-30 баллов - «3»
31-35 баллов - «4»
36 баллов и более – «5»
|
1.11 Вопросы к зачету.
- Основные химические понятия: элемент, атом, молекула. Простое и сложное вещество. Физические и химические явления. Вещество и поле как виды материи и соотношение между ними.
- Основные химические законы: постоянства состава, кратных отношений, закон эквивалентов. Законы сохранения: энергии, массы, заряда.
- Закон Авогадро и его следствия. Моль как мера количества вещества. Молярная масса, молярный объём газа. Переход от массы к количеству вещества.
- Строение атома: ядро, протоны, нейтроны, электроны. Понятие об электронных орбиталях и квантовых числах.
- Основные свойства атомов: заряд ядра, радиус, потенциал ионизации, сродство к электрону, электроотрицательность. Изменение этих свойств в периодах и группах. Металлические и неметаллические свойства элементов в зависимости от их положения в ПС.
- Степень окисления. Окислители и восстановители.
- Основные классы химических соединений: бинарные соединения, гидроксиды (кислоты и основания), соли (средние, кислые, основные, двойные). Номенклатура, основные способы получения и химические свойства.
- Природа и виды химической связи: ковалентная, полярная, ионная, донорно-акцепторная. Водородная связь. Энергия и длина связи, кратные связи.
- Основные понятия химической термодинамики: системы, параметры, процессы. Критерии самопроизвольного протекания процессов.
- Закон Гесса и его следствия. Термохимические уравнения. Методы расчёта тепловых эффектов химических реакций.
- Термодинамика процессов растворения газов, жидкостей и кристаллических веществ в воде.
- Понятие о растворах и способы выражения их состава: массовая доля, молярность, нормальность.
- Дисперсные системы. Классификация. Особенности физико- химических свойств.
- Скорость химической реакции, константа скорости и её зависимость от температуры и катализатора. Уравнение Аррениуса. Понятие об энергии активации.
- Химическое равновесие. Константа равновесия, смещение равновесия. Влияние концентрации, температуры и давления на равновесие. Принцип Ле Шателье.
- Электролитическая диссоциация кислот, оснований и солей с точки зрения химического равновесия. Степень диссоциации, константа диссоциации. Сильные и слабые электролиты.
- Гидролиз растворов солей.
- Окислительно-восстановительные реакции (ОВР). Метод ионно-электронного баланса при составлении уравнений ОВР.
- Понятие об электролизе. Электролиз расплавов бескислородных солей, водных растворов кислот, щелочей и солей.
- Общая характеристика металлов по их положению в ПСХЭ Д.И. Менделеева. Строение атомов, металлическая связь. Характерные химические свойства.
- Общая характеристика неметаллов по их положению в ПСХЭ Д.И. Менделеева. Строение атомов. Характерные соединения неметаллов и их свойства.
- Водород в природе, получение, физические и химические свойства.
- Кислород, его получение в лаборатории, физические и химические свойства.
- Сера в природе, её получение, аллотропия и химические свойства.
- Азот и его соединения, физико-химические свойства, получение в лаборатории.
- Фосфор и его соединения, физические и химические свойства.
- Методы аналитической химии. Выполнение аналитических реакций.
- Активность. Коэффициент активности. Ионная сила раствора.
- Электролиты. Закон разведения Оствальда.
- Водородный показатель рН. Расчеты рН.
- Равновесие в системе осадок-раствор. Произведение растворимости.
- Качественный анализ Качественный систематический анализ катионов по кислотно-щелочному методу.
- Гравиметрические методы анализа.
- Объемные (титрометрические) методы анализа.
- Окислительно-восстановительные (редокс) методы титрования.
- Физико-химические (инструментальные) методы анализа.
- Классификация органических соединений. Особенности строения атома углерода, основные функциональные группы.
- Виды изомерии органических соединений.
- Основные типы связей в органических соединениях и их характеристики. Гомолитический и гетеролитический разрыв связей.
- Классификация химических реакций в органической химии.
- Предельные углеводороды: гомологический ряд, изомерия, химические свойства, получение, применение.
- Непредельные углеводороды: классификация, изомерия, характерные химические свойства, получение, применение.
- Кислородсодержащие органические соединения: классификация, функциональные группы, изомерия, характерные химические свойства, получение, применение.
- Углеводы: классификация, изомерия, характерные химические свойства, получение, применение.
- Азотсодержащие органические соединения: классификация, изомерия, характерные химические свойства, получение, применение.
- Непредельные углеводороды: классификация, изомерия, характерные химические свойства, получение, применение.
- Высокомолекулярные органические соединения. Основные отличия свойств полимеров от свойств низкомолекулярных соединений.
- Основные методы синтеза полимеров: радикальная и ионная полимеризация (инициирование, рост и обрыв цепи), поликонденсация.
- Важнейшие представители карбоцепных (полиэтилен, полипропилен, поливинилхлорид, полиметилметакрилат, полиизопрен, тефлон) и гетероцепных (полиамиды и полиэфиры) синтетических полимеров, области их практического применения.
- Белки, нуклеиновые кислоты и полисахариды как важнейшие представители биополимеров.
Ответы на вопросы необходимо обязательно иллюстрировать примерами с использованием химических веществ и при необходимости - химическими уравнениями реакций.
1.13. Тематика рефератов.
1.14 Примерная тематика курсовых работ.
1.15 Примерная тематика квалификационных (дипломных) работ.
1.16 Методика исследования.
По учебному плану выполнение не предусмотрено.
1.17 Бально-рейтинговая система, используемая преподавателем для оценивания знаний студентов по данной дисциплине.
Посещение лекций – 120 баллов (по 4 балла за каждую)
Модуль 1 «Общая химия»
Работа на практических занятиях (семинарах) – до 5 баллов (итого 50 баллов)
Самостоятельная работа студента:
ПЗ №1 – до10 баллов.
ПЗ №2 – до 10баллов.
ПЗ №3 – до 14 баллов.
ПЗ №4 – до 10 баллов.
ПЗ №5 – до 10 баллов.
ПЗ №6 – до 10 баллов.
ПЗ №7 – до 10 баллов.
ПЗ №8 – до 10 баллов.
ПЗ №9 – до 10 баллов.
ПЗ №10 – до 10 баллов.
Вводное тестирование – 25 баллов
Тестирование по темам «Основные химические понятия. Строение атома. Термоди- намика. Кинетика» – 25 баллов
Тестирование по теме «Истинные растворы, растворы электролитов» – 25 баллов
Тестирование по теме «Дисперсные системы» – 25 баллов
Итого: 225 баллов.

Функция спроса населения на данный товар Функция спроса населения на данный товар: Qd=7-Р. Функция предложения: Qs= -5+2Р,где...
|

Аальтернативная стоимость. Кривая производственных возможностей В экономике Буридании есть 100 ед. труда с производительностью 4 м ткани или 2 кг мяса...
|

Вычисление основной дактилоскопической формулы Вычислением основной дактоформулы обычно занимается следователь. Для этого все десять пальцев разбиваются на пять пар...
|

Расчетные и графические задания Равновесный объем - это объем, определяемый равенством спроса и предложения...
|
|
Деятельность сестер милосердия общин Красного Креста ярко проявилась в период Тритоны – интервалы, в которых содержится три тона. К тритонам относятся увеличенная кварта (ув.4) и уменьшенная квинта (ум.5). Их можно построить на ступенях натурального и гармонического мажора и минора.
...
Понятие о синдроме нарушения бронхиальной проходимости и его клинические проявления Синдром нарушения бронхиальной проходимости (бронхообструктивный синдром) – это патологическое состояние...
Опухоли яичников в детском и подростковом возрасте Опухоли яичников занимают первое место в структуре опухолей половой системы у девочек и встречаются в возрасте 10 – 16 лет и в период полового созревания...
|
|
Виды сухожильных швов После выделения культи сухожилия и эвакуации гематомы приступают к восстановлению целостности сухожилия...
КОНСТРУКЦИЯ КОЛЕСНОЙ ПАРЫ ВАГОНА Тип колёсной пары определяется типом оси и диаметром колес. Согласно ГОСТ 4835-2006* устанавливаются типы колесных пар для грузовых вагонов с осями РУ1Ш и РВ2Ш и колесами диаметром по кругу катания 957 мм. Номинальный диаметр колеса – 950 мм...
Философские школы эпохи эллинизма (неоплатонизм, эпикуреизм, стоицизм, скептицизм). Эпоха эллинизма со времени походов Александра Македонского, в результате которых была образована гигантская империя от Индии на востоке до Греции и Македонии на западе...
|
|

 C2H4+H2
C2H4 + Н2О
C2H4+H2
C2H4 + Н2О 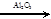 С2Н5ОН
С2Н5ОН
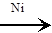 C2H6
C2H6+Cl2® C2H5Cl + HCl
C2H6
C2H6+Cl2® C2H5Cl + HCl
 CHº C –CH=CH2
CHº C –CH=CH2
 СН2ОН– СН2ОН
СН2ОН– СН2ОН
 C3H8O
C3H8O
 CH2=CH–CH=CH2 + 2H2O
CH2=CH–CH=CH2 + 2H2O
 C2H6
C2H6 + Cl2 ® C2H5Cl
C2H5Cl + 2Na ® C4H10 + 2NaCl
C4H10 + 2Br2®C4H8Br2 + 2HBr
C2H6
C2H6 + Cl2 ® C2H5Cl
C2H5Cl + 2Na ® C4H10 + 2NaCl
C4H10 + 2Br2®C4H8Br2 + 2HBr
 C6H6
C6H6
 CH2=CCl–CH=CH2 + НСl
CH2=CCl–CH=CH2 + НСl
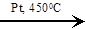 2C6H12 + C6H6
C6H6 + CН3Сl ® C6H5CH3 + HCl
2C6H12 + C6H6
C6H6 + CН3Сl ® C6H5CH3 + HCl



