Примеры. 1. Рассчитать состав равновесной газовой смеси, получающейся в результате взаимодействия эквивалентной смеси водорода и азота по реакции 3H2 + N2 Û 2NH31. Рассчитать состав равновесной газовой смеси, получающейся в результате взаимодействия эквивалентной смеси водорода и азота по реакции 3H2 + N2 Û 2NH3 при давлении р и температуре Т = 700 К. Рассчитать выход аммиака. Решение. А. Расчет константы равновесия KX (Т, р). Определяем изменение энергии Гиббса при протекании реакции 3H2 + N2 Û 2NH3 D fH 0298, кДж/моль 0 0 –45, 94 S 0298, Дж/моль× K 130, 52 191, 50 192, 66 Изменение энергии Гиббса при температуре Т = 700 К D rG 0(700) можно вычислить по энтальпии и энтропии реакции при Т =298 К, D rG 0 (Т)»D rН 0298 – Т × D rS 0298, D rН 0298=(å n i × D fН 0298 i )продукты–(å n i × D fН 0298 i )исх. вещества, D rS 0298=(å n i × S 0298 i )продукты– (å n i × S 0298 i ) исх. вещества, D rН 0298 = 2× (–45, 94) – (3× 0 +1× 0) = –91, 88 кДж, D rS 0298 = 2× (192, 66) – (3× 130, 52 +1× 191, 50)= –197, 74 Дж/K, D rG 0298 = –91, 88 × 103– 700× (–197, 74) = 46540Дж. Рассчитываем величину К 0(700)=3, 37× 10-4, KX (700)= К 0(700)× (p/p 0)–Dn= К 0(700)× ( Dn =(2)–(3+1)= –2. Б.) Расчет состава (мольные доли) газовой смеси в состоянии равновесия при Поскольку водород и азот в начальный момент времени находятся в эквивалентных количествах, то на 3 моля водорода приходится 1 моль азота. Пусть к моменту прихода системы к равновесию израсходовалось x молей азота. Тогда в равновесной газовой смеси будет приходиться на n Н2=3–3× x молей водорода в соответствии с уравнением реакции n N2=1– x молей азота и n NH3=2× x молей аммиака: 3H2 + N2 Û 2NH3 3-3× x 1- x +2× x Суммарное число молей веществ в равновесной смеси S n i = (3–3× x)+(1– x)+(2× x) =2× (2– x). Тогда мольная доля i -го вещества будет равна соответственно: X H2= Константа равновесия KX будет равна:
Условию задачи соответствует решение данного уравнения x = 0, 0117. Определив x, можно рассчитать мольные доли (Xi) компонентовв равновесной газовой смеси. Результаты расчета приведены в табл. 3.1. Если бы реакция была необратима, то из 3 молей водорода и 1 моля азота образовалось бы 2 моля аммиака. Расчет показывает, что вследствие обратимости реакции в этих условиях образовалось только 2× x =0, 00234 молей аммиака. Таким образом, выход целевого продукта составил величину (0, 0234 /2)× 100%=1, 17%. Увеличить выход целевого продукта можно сместив равновесие, например изменив давление. Результаты расчета приведены в табл. 3.1. Таблица 3.1 Состав (мольные доли компонентов Xi) равновесной газовой смеси реакции 3H2 + N2 Û 2NH3 при Т =700 К при различных давлениях
Данные таблицы показывают, что увеличение давления приводит к увеличению выхода аммиака. 2. Расчет степени термической диссоциации тетрооксида диазота (N2О4) по реакции N2О4 Û 2 NО2 при температуре Т и давлении р. Решение. А. Расчет константы равновесия KX (Т, р). Определяем изменение энергии Гиббса при протекании реакции N2О4 Û 2 NО2 D fH 0298, кДж/моль 11, 11 34, 19 S 0298, Дж/моль× K 304, 35 240, 06 Изменение энергии Гиббса при температуре Т D rG 0(Т) можно вычислить по энтальпии и энтропии реакции при Т =298 К: D rG 0(Т)» D rН 0298 – Т × D rS 0298, D rН 0298= (å n i × D fН 0298 i )продукты–(å n i × D fН 0298 i )исх. вещества , D rS 0298=(å n i × S 0298 i )продукты–(å n i × S 0298 i ) исх. вещества , D rН 0298 = 2× (34, 19) – (11, 11) = 57, 27 кДж, D rS 0298 = (2× 240, 06) – 304, 35 = 175, 77 Дж/K, D rG 0298 = 57, 27× 103–323× 175, 77 = 496, 29 Дж. Рассчитываем величину Поскольку для данной реакции Dn =(2)–(1)= +1, то KX (T, р)= К 0(T)× (p/p 0)–1= К 0(T)× ( Б. Расчет состава (мольные доли) газовой смеси в состоянии равновесия. Пусть к моменту равновесия из каждого моля N2О4 распалось x молей. Тогда в равновесной газовой смеси будет приходиться на n N2О4= 1– x молей тетрооксида диазота n NО2= 2× x молей диоксида азота: N2О4 Û 2 NО2 1– x 2× x Суммарное число молей N2О4 и NО2 в равновесной смеси: S ni = (1– x) + (2× x) = 1+ x. Тогда мольная доля веществ в равновесной смеси Xi = ni /S ni будет равна: X N2О4= Для константы равновесия KX можно написать:
откуда x = В. Расчет степени диссоциации N2О4. Степень диссоциации (a) – это доля молекул вещества от их начального количества, которая подверглась диссоциации. Поскольку к моменту равновесия из одного моля N2О4 распалось на NО2 x молей, то x º a: a(T, p)= Таким образом, степень диссоциации N2О4 зависит от температуры и давления. Например, при Т =100°С и
Рис. 3.2. Зависимость степени диссоциации N2О4 (a) от давления р при постоянной температуре Т =100°С (а) и от температуры Т при постоянном давлении р =1атм(б) Степень диссоциации N2О4 является количественной характеристикой смещения равновесия реакции N2О4 Û 2 NО2. При a®1 равновесие в системе смещено в сторону образования продуктов диссоциации. Увеличение давления приводит к уменьшению a, а увеличение температуры – к увеличению a. Эти закономерности полностью соответствуют выводам анализа уравнений изобары и изотермы реакции.
|

 и
и  :
: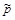 )–Dn,
)–Dn, , X N2=
, X N2=  , X NH3=
, X NH3=  .
. .
. , атм
, атм
 и
и  .
. , X NО2=
, X NО2=  .
.
 .
. =14, 50, a= 0, 885, X N2O4= 0, 061, X NO2= 0, 939.
=14, 50, a= 0, 885, X N2O4= 0, 061, X NO2= 0, 939. Результаты аналогичных расчетов для реакции диссоциации N2О4 в графическом виде представлены на рис.3.2.
Результаты аналогичных расчетов для реакции диссоциации N2О4 в графическом виде представлены на рис.3.2.




