Типы химической связи.Химическая связь – это взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной энергии системы. В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую. Основные характеристики связи. Энергия связи (Е, кДж/моль) – количество энергии, выделяющееся при образовании химической связи. Чем больше энергия связи, тем устойчивее молекулы. Длина связи – расстояние между ядрами химически связанных атомов. Кратность связи – определяется количеством электронных пар, связывающих два атома. С увеличением кратности связи длина связи уменьшается, а прочность ее возрастает. Валентный угол – угол между воображаемыми линиями, которые можно провести через ядра связанных атомов. Валентный угол определяет геометрию молекул. Дипольный момент возникает, если связь образована между атомами элементов с разной электроотрицательностью и служит мерой полярности молекулы. Ковалентная связь образуется путем обобществления пары электронов двумя атомами. Особенностями ковалентной химической связи являются ее направленность и насыщаемость. Направленность обусловлена тем, что атомные орбитали имеют определенную конфигурацию и расположение в пространстве. Перекрывание орбиталей при образовании связи осуществляется по соответствующим направлениям. Насыщаемость обусловлена ограниченными валентными возможностями атомов. Различают ковалентную полярную и неполярную связь. Ковалентная неполярная связь образуется между атомами с одинаковой электроотрицательностью; обобществленные электроны равномерно распределены между ядрами взаимодействующих атомов. Ковалентная полярная связь образуется между атомами с различной электроотрицательностью; общие электронные пары смещены в сторону более электроотрицательного элемента. Описание связей в молекуле основано на определении распределения электронной плотности вблизи ядра. Это трудная, а зачастую и неразрешимая задача. Поэтому на практике используют упрощенные методы – метод валентных связей (ВС) и метод молекулярных орбиталей (МО). Метод ВС рассматривает химическую связь как результат притяжения ядер двух атомов к одной или нескольким общим для них электронным парам. Возможны два механизма образования ковалентной связи: 1) спаривание электронов двух атомов при условии противоположной ориентации их спинов (обменный механизм); 2) донорно-акцепторное взаимодействие, при котором общей становится электронная пара одного из атомов (донора) при наличии энергетически выгодной свободной орбитали другого атома (акцептора). Часто в образовании связи участвуют электроны разных подуровней, а, следовательно, орбитали разных конфигураций. В этом случае может происходить гибридизация (смешение) электронных облаков (орбиталей). Образуются новые, гибридные облака с одинаковой формой и энергией. Число гибридных орбиталей равно числу исходных. В гибридной АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание, приводящее к повышению энергии связи. Гибридизация АО определяет пространственную конфигурацию молекул.
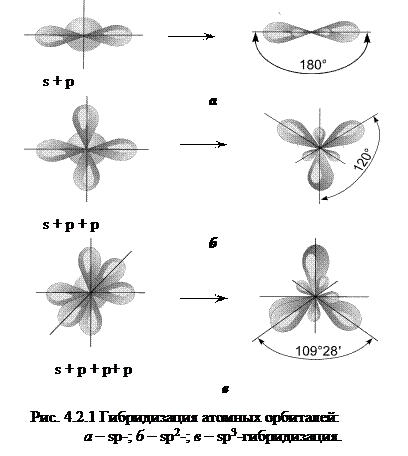
Так, при смешении одной s -орбитали и одной p -орбитали, образуются две гибридные орбитали, угол между которыми 180о, такой тип гибридизации называется sp -гибридизацией (рис. 4.2.1, а). Молекулы, в которых осуществляется sp -гибридизация, имеют линейную геометрию (C2H2, BeF2). При смешении одной s и двух p -орбиталей образуются 3 гибридные орбитали, угол между которыми 120о. Такой тип гибридизации называется sp 2-гибридизацией, ему соответствует образование плоской треугольной молекулы (BF3, C2H4) (рис. 4.2.1, б). При смешении одной s и трех p -орбиталей образуются четыре sp 3-гибридные орбитали, угол между которыми 109о28'. Форма такой молекулы является тетраэдрической (рис. 4.2.1, в). Примеры таких молекул: CCl4, CH4, GeCl4. При определении типа гибридизации необходимо также учитывать неподеленные электронные пары элемента. Например, кислород в молекуле воды (Н2О) имеет sp3-гибридизацию (4 гибридных орбитали), а химическая связь с атомами водорода образована двумя электронными парами. Возможны также более сложные виды гибридизации с участием d и f- орбиталей атомов. Ионная связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Ее можно рассматривать как предельный случай ковалентной полярной связи. Такая связь возникает лишь в случае большой разности электроотрицательностей взаимодействующих атомов, например между катионами s -металлов I и II групп периодической системы и анионами неметаллов VI и VII групп (LiF, CsCl, KBr и др.). Так как электростатическое поле иона имеет сферическую симметрию, то ионная связь не обладает направленностью. Ей также не свойственна насыщаемость. Все ионные соединения в твердом состоянии образуют ионные кристаллические решетки, в узлах которых каждый ион окружен несколькими ионами противоположного знака. Чисто ионной связи не существует. Можно говорить лишь о доле ионности связи. Металлическая связь. В отличие от ковалентных и ионных соединений в металлах небольшое число электронов одновременно связывает большое число ядерных центров, а сами электроны могут перемещаться в металле. Таким образом, в металлах имеет место сильно нелокализованная химическая связь.Подробнее металлическая связь рассмотрена во второй части учебного пособия.
|