Теорія електролітичної дисоціаціїРозпад електроліту на йони під дією полярних молекул розчинника або високої температури називається процесом електролітичної дисоціації (йонізації).
NaC1крист. Na1+ + C11− К2SO4 2К1+ + SO42– . Однією з кількісних характеристик процесу електролі-тичної дисоціації (йонізації) є ступінь дисоціації (α − альфа). Ступінь дисоціації – це відношення числа N молекул, що розпалися на йони до загального числа Nзаг. розчинених молекул речовини: a = Якщо α > 0,3, то такий електроліт вважається сильним, а якщо α < 0,3 – слабким. Ступінь дисоціації залежить від: 1). природи розчинника: чим більш полярна молекула розчин-ника, тим вищий ступінь йонізації (дисоціації) речовини, що розчиняється; 2). температури − вплив температури можна оцінити за принципом Ле Шательє: якщо електролітична дисоціація – ендотермічний процес, то з підвищенням температури сту-пінь йонізації зростає, а при зниженні – падає. 3) концентрації розчину: чим менша концентрація речовини в розчині, тим більший ступінь дисоціації речовини в ньому. Нехай дана важкорозчинна речовина КatАn з певною молярною концентрацією (с (Х)) та певним ступенем йонізації (дисоціації) (a (Х)). У воді відбувається процес йонізації (дисоціації):
за р.р. n 1 моль 1 моль 1 моль рівноважна с с−aс aс aс Тоді: Кйон. = = У разі слабкого електроліту α<<1, тоді знаменик наближається до одиниці. Формула набуває вигляду: Кйон. = сα2. Зазначене співвідношення називається законом розбав-лення Оствальда.
7.6. Поняття про сильні електроліти. Активність У сильних електролітів ступінь дисоціації високий, що призводить до накопичення в розчині великої кількості йонів, а це в свою чергу викликає взаємодію протилежно заряджених йонів. При цьому йони підходять один до одного на близьку відстань і утворюють, так звану, йонну пару – складний агрегат, що утворений із двох протилежно заряджених йонів, які оточені молекулами розчинника. Такий процес називається асоціацією; він призводить до того, що реальна концентрація йонів у розчині зменшується. У 1917 році Льюїс увів формальне уявлення про ефективну концентрацію – активність. Активність зв’язана з дійсною концентрацією розчиненої речовини таким співвідношенням: а = f × с (Х), де а – активність, с (Х) – молярна концентрація речовини, f – коефіцієнт активності, який можна визначити за довідником, попередньо знайшовши йонну силу розчину (m), яка дорівнює напівсумі добутків концентрації кожного йону на квадрат його заряду: m = 0,5(с1×z12 + с2×z22 + … сn×zn2)
7.7. Визначення сили кислот і основ. Схема Косселя Характер електролітичної дисоціації гідроксидів загаль-ної формули сполуки ЕОН залежить від порівняння міцності зв’язків Е–О та О – Н і може протікати за двома типами:
При співвідношенні сили основних гідроксидів мова йде про міцність зв’язку І-го типу, а при оцінці сили кислотних гідроксидів розглядається міцність зв’язку ІІ-го типу. Суть схеми Косселя полягає в застосуванні до частинок, що утвори-лися внаслідок процесу дисоціації, закону Кулона: F = k F – сила взаємодії; q – заряд частинок; r – відстань між частинками; k – коефіцієнт пропорційності І тип розриву зв’язків (визначення сили основи). Між центральним атомом і гідроксильною групою, що дисоціює, виникає сила притягання. Наприклад:
НО−Fe2+−OН–1 Fe3+−OН–1 HO a) б) У випадку а) і б) відстань між атомами заліза і гідроксильною групою однакова, тому, враховуючи значення зарядів, на центральному атомі, констатуємо, що сила притя-гання у випадку б) більша. Отже, основні властивості у Fe(ОН)3 виражені слабше.
НО−Са2+−OН1− НО−Ва2+−OН1− в) г) сила притягання між частинками буде більшою там, де менший радіус, тобто у випадку в). Тому сильнішою основою буде Ва(ОН)2. Отже, сильнішою основою є сполука, у якої менший ступінь окиснення та більший радіус центрального атома. ІІ тип розриву зв’язків (визначення сили кислот). Між центральним атомом і Гідроген-іоном кислоти, що дисоціює, виникає сила відштовхування (бо заряджені ці частинки однаково). Наприклад:
О = S S О−Н О О−Н а) б) У випадку а) і б) відстань між атомами Сульфуру та Гідроґену однакова. Тому силу відштовхування визначає вели-чина умовного заряду на атомі Сульфуру. Звідси висновок: сильнішою буде кислота з більшим зарядом на атомі Сульфуру, тобто сульфатна кислота Н2SО4 (б). Порівнюючи силу кислот, що різняться радіусами центральних атомів,
S Sе О О−Н О О−Н в) г) констатуємо, що сильнішою буде та кислота, що має менший радіус центрального атому, а тому сильнішою є Н2SО4 (в). Отже, сильнішою кислотою є сполука, у якої більший умовний заряд на центральному атомі та менший його радіус.
|


 , або a =
, або a =  =
= 
 КatАn Кat1+ + Аn1−
КatАn Кat1+ + Аn1− =
=  =
=  =
=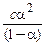 .
. І. ЕОН Е+ + ОН–
І. ЕОН Е+ + ОН– ІІ. ЕОН ЕО– + Н+
ІІ. ЕОН ЕО– + Н+ , де
, де HO
HO

 О−Н1+ О О−Н1+
О−Н1+ О О−Н1+ О О−Н1+ О О−Н1+
О О−Н1+ О О−Н1+


