АНАЛИЗ КАЧЕСТВА ДИСПАНСЕРИЗАЦИИЗадача № 1 «Про ізомерні сполуки»
В лабораторній роботі у школяра Сашка було завдання — знайти формулу сполуки, яка містить 64,82 % Карбону (за масою), 13,6 % Гідрогену, решта – Оксиген. Йому було видано чотири пробірки з рідинами (1)–(4), які були між собою ізомерами вищезгаданого складу. Виявилося, що всі ці сполуки реагують з металічним натрієм із виділенням газу. Сашко також виявив, що рідина (1) дає пробу Лукаса (обробка речовини розчином ZnCl2 у концентрованій HCl) за звичайних умов, а сполука (3) – при нагріванні. Учитель навіть показав школярам ПМР спектри сполук (1)–(4), оскільки був упевнений, що вони їм не допоможуть. Сашко встиг запам’ятати лише те, що в спектрах сполук (2) і (3) найбільше сигналів, у сполуки (4) – трохи менше їх, а в сполуки (1) сигналів було найменше. Допоможіть Сашку знайти структурні формули цих сполук і визначити номери пробірок, у яких вони знаходяться. Відповідь обґрунтуйте.
Відповідь. 1 – (CH3)3COH, 2 – CH3CH2CH2CH2OH, 3 – CH3CH(OH)CH2CH3, 4 – (CH3)2CHCH2OH. Задача № 2 «Проблеми очищення речовин…» Перекристалізація – метод очищення речовин, що полягає у розчиненні їх у гарячому розчиннику (для неорганічних солей звичайно використовують воду) та наступному охолодженні одержаного розчину. Визначте масу MgSO4×6H2O, що містить 7% домішок, із якої при перекристалізації в інтервалі температур від 70 до 20 оС можна добути 1 кг чистого кристалогідрату. Розчинність безводного MgSO4 (у грамах на 100 г води) становить 59,0 при 70 оС та 44,5 при 20 оС. Вважайте, що домішки при перекристалізації в осад не виділяються.
Відповідь. m = 2623 г Задача № 3 «Трохи кольорової хімії»
Сполуки у наведеній нижче схемі перетворень яскраво забарвлені, що й не дивно, бо всі вони містять елемент Х, назва якого переводиться з латинської мови як «кольоровий». Перетворення A в B, C та F в D проводяться із твердими речовинами, всі інші – у водних розчинах.
Сполуки А та С – кристали оранжевого кольору, причому С містить 41,26 % елементу Х, 3,20 % гідрогену, 11,11 % нітрогену, решта – оксиген. Реакція термічного розкладу С із утворенням сіро-зеленого порошку D – один з найкрасивіших демонстраційних дослідів. Речовина В – оксид елементу Х, має темно-червоний колір. Е може бути виділена у вигляді великих фіолетових кристалів у формі правильних октаедрів, ці кристали містять 10,41 % елементу Х, 4,84 % гідрогену, 12,84 % сульфуру, 7,83 % калію, решта – оксиген. F – сіро-фіолетовий осад. G – розчинна сполука зеленого кольору. H – жовта речовина. Знайдіть елемент Х. Розшифруйте сполуки А – H. Напишіть рівняння всіх згаданих хімічних реакцій.
Відповідь. За елементним складом С встановлюємо, що це (NH4)2Cr2O7. X - Cr; A - K2Cr2O7; B - CrO3; D - Cr2O3; E - KCr(SO4)2∙12H2O; F – Cr(OH)3; G – K3[Cr(OH)6]; H – K2CrO4. Задача № 4 «Отруйний газ»
Речовина Х – отруйний газ (н. у.), що активно реагує з водою і має дуже вузький температурний інтервал рідкого стану (за нормального тиску температура кипіння лише на 4OC вища за температуру плавлення). Для добування газу Х у промисловості оксид А (w(О) = 53,33%) розчиняють у фторидній кислоті, а отриманий розчин B обробляють розчином BaCl2. Осад C, що утворюється, відфільтровують, висушують і нагрівають до 300 OC; при цьому утворюються газ Х і твердий залишок D. 1) Визначте сполуки А – D та газ Х. Відповідь обґрунтуйте розрахунками. 2) Наведіть хімічні рівняння для всіх згаданих перетворень. 3) Яку просторову будову мають молекули газу Х та аніон солі С? 4) Напишіть рівняння реакцій, що можуть відбуватися при взаємодії Х з водою. Які з цих реакцій є зворотними?
Розв’язок. 1) X – SiF4, A – SiO2, B – H2SiF6, C – BaSiF6, D – BaF2. 2) SiO2 + 6HF = H2SiF6 BaCl2 + H2SiF6 = 2HCl + BaSiF6 BaSiF6 = BaF2 + SiF4 3) SiF4 – тетраедр з атомом силіцію в центрі та атомами флуору в вершинах; [SiF6]2- - октаедр з атомом силіцію в центрі та атомами флуору в вершинах. 4) SiF4 + 2H2O = SiO2 + 4HF або SiF4 + 3H2O = H2SiO3 + 4HF – зворотній процес 3SiF4 + 2H2O = 2H2SiF6 + SiO2 або 3SiF4 + 3H2O = 2H2SiF6 + H2SiO3 – незворотній процес. Задача № 5 «Органічний ланцюг»
Розшифруйте ланцюг таких перетворень:
Відомо, що А та G — вуглеводні, що мають однакову формулу С4Н6. А дає осад з амоніачним розчином арґентум оксиду, а G – ні. Напишіть рівняння реакцій та назвіть органічні сполуки А — G. Розв’язок.
Задача № 6 «Трохи про ціаніди…» У шкільному курсі хімії вивчають реакції нейтралізації – взаємодію основ з кислотами з утворенням солей і води. Проте нерідко реакція може проходити і в зворотному напрямі; відбувається гідроліз відповідної солі. У 100 мл води за стандартних умов розчинили 6,5 г KCN. (Змінами об’єму при розчиненні знехтуйте.) 1. Обчисліть масову частку та молярну концентрацію KCN в утвореному розчині. 2. Напишіть молекулярне та скорочене йонне рівняння гідролізу калій ціаніду. 3. Обчисліть константу гідролізу, врахувавши, що константа дисоціації HCN Ка =1.3 ∙ 10-9 моль/л, а йонний добуток води Kw = 10-14 моль2/л2. 4. Обчисліть ступінь гідролізу калій ціаніду в утвореному розчині. 5. Обчисліть рН розчину KCN. 6. Чому KCN гідролізує, а KCl – ні? 7. Яким стане рН розчину, якщо до нього додати ще 0,01 моль HCN?
Розв’язок. 1. KCN + H20 = KOH + HCN CN- + H2O = HCN + OH- 2. w (KCN) = 6.5/106.5 = 6.1 % C (KCN) = (6.5/65)/0.1 = 1 моль/л 3. Kh = 4. Нехай прогідролізувало х моль/л KCN, тоді Для малих значень х Kh ≈ х 2 Звідки х = 2,8 ∙ 10-3 моль/л α = 2,8 ∙ 10-3 /1 = 0,28 % 5. [OH-] = pOH = 2.55 pH = 14-2.55 = 11.45 6. Хлорид не гідрлізує, оскільки хлорид на кислота є сильною і її утворення не зміщує рівновагу, на відміну від ціанідної кислоти що дисоціює слабко. 7. Наявність солі з однойменним йоном подавляє дисоціацію кислоти. Тому [OH-] = Задача № 7 «І в хімічних реакціях буває порядок…» У реакції n А → В, яка має цілий порядок, концентрація вихідної речовини 1,5 моль∙л–1 була досягнута за 3 хв при її початковій концентрації 3,0 моль∙л–1 та за 4,5 хв при початковій концентрації 6,0 моль∙л–1. 1. Знайдіть порядок указаної реакції. У певний момент часу швидкість витрачання А становила 0,8 моль∙л–1∙хв–1. 2. Знайдіть швидкість утворення В у цей момент. 3. За який час буде досягнуто концентрацію вихідної речовини 2,0 моль∙л–1 при її початковій концентрації 3,0 моль∙л–1? 4. Знайдіть відношення часу напівперетворення ( 5. Чи залежить величина Розв’язок. 1. З умови задачі зрозуміло, що в другому досліді концентрація 3,0 моль∙л–1 була досягнута за 4,5 – 3 = 1,5 хв, і це час напівперетворення при початковій концентрації 6,0 моль∙л–1. А 3 хв – це час напівперетворення при початковій концентрації 3,0 моль∙л–1. Отже час напівперетворення залежить від початкової концентрації речовини, причому обернено пропорційно 2. Із стехіометрії реакції 3. Для вказаної реакції другого порядку 4. Для реакції другого порядку 5. Перевіримо, чи залежить
Можна зробити висновок, що величина
АНАЛИЗ КАЧЕСТВА ДИСПАНСЕРИЗАЦИИ
|



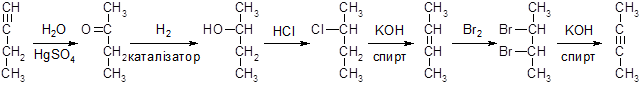
 = Kw / Kа = 10-14/1.3 ∙ 10-9 = 7.7 ∙ 10-6 моль/л
= Kw / Kа = 10-14/1.3 ∙ 10-9 = 7.7 ∙ 10-6 моль/л
 = 2,8 ∙ 10-3 M
= 2,8 ∙ 10-3 M =
=  = 7.7 ∙ 10-5 моль/л pH = 9.89
= 7.7 ∙ 10-5 моль/л pH = 9.89 ) до часу перетворення речовини на третину (
) до часу перетворення речовини на третину ( ) для цієї реакції. Чи залежить це відношення від початкової концентрації вихідної речовини?
) для цієї реакції. Чи залежить це відношення від початкової концентрації вихідної речовини? від порядку реакції? Для відповіді на це питання знайдіть
від порядку реакції? Для відповіді на це питання знайдіть  . Для реакції першого порядку кінетичне рівняння має вигляд
. Для реакції першого порядку кінетичне рівняння має вигляд  , час напівперетворення
, час напівперетворення  , від порядку не залежить. Для реакції другого порядку кінетичне рівняння
, від порядку не залежить. Для реакції другого порядку кінетичне рівняння  дає час напівперетворення
дає час напівперетворення  , тобто час напівперетворення обернено пропорційний концентрації вихідної речовини, тож реакція має другий порядок.
, тобто час напівперетворення обернено пропорційний концентрації вихідної речовини, тож реакція має другий порядок.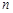 А→В випливає, що швидкість витрачання А буде в
А→В випливає, що швидкість витрачання А буде в  л∙моль–1∙хв–1, звідки час, за який концентрація А зменшилася до 2,0 моль/л (фактично вона становить 2/3
л∙моль–1∙хв–1, звідки час, за який концентрація А зменшилася до 2,0 моль/л (фактично вона становить 2/3  , а перетворення відбулося на одну третину)
, а перетворення відбулося на одну третину) 
 , від початкової концентрації не залежить.
, від початкової концентрації не залежить. від початкової концентрації для реакції іншого цілого порядку, наприклад, першого:
від початкової концентрації для реакції іншого цілого порядку, наприклад, першого:  ;
; .
.


