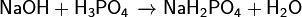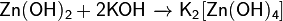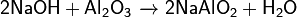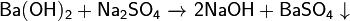Основаниями называются вещества, в которых атомы металла связаны с гидрокси-группами.Существует также основание, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Это основание называется гидроксидом аммония и имеет формулу NH4OH. Гидроксид аммония образуется в рекции присоединения воды к аммиаку, когда аммиак растворяют в воде: NH3 + H2O = NH4OH (гидроксид аммония). Основания бывают растворимыми и нерастворимыми. Растворимые основания называются щелочами. Растворы щелочей скользкие на ощупь ("мыльные") и довольно едкие. Они разъедают кожу, ткани, бумагу, очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками. Если раствор щелочи все-таки попал в лицо, необходимо промыть глаза большим количеством воды, а затем разбавленным раствором слабой кислоты (например, уксусной). Этот способ медицинской помощи основан на уже известной нам реакции нейтрализации. NaOH + уксусная кислота (разб.) = соль + вода Лишь небольшую часть всех оснований называют щелочами. Это, например, KOH – гидроксид калия (едкое кали), NaOH – гидроксид натрия (едкий натр), LiOH – гидроксид лития, Ca(OH)2 – гидроксид кальция (его раствор называется известковой водой), Ba(OH)2 – гидроксид бария. Большинство других оснований в воде нерастворимы и щелочами их не называют. Основа́ния — класс химических соединений. · Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называютсящелочами. · Согласно протонной теории кислот и оснований, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов. · В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли») с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание», так и в виде «солей алкалоидов». В статье смысл термина «основание» раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды. \Получение
· Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь.
Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя. · Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
· Также основание можно получить при взаимодействии щелочного или щелочноземельного металла с водой.
· Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей:
· Некоторые основания можно получить реакциями обмена:
· Основания металлов встречаются в природе в виде минералов, например: гидраргиллита Al(OH)3, брусита Mg(OH)2. Классификация Основания классифицируются по ряду признаков. · По растворимости в воде. · Растворимые основания (щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2,гидроксид цезия CsOH, гидроксид рубидия RbOH. · Практически нерастворимые основания: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2. · Другие основания: NH3·H2O Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов · По количеству гидроксильных групп в молекуле. · Однокислотные (гидроксид натрия NaOH) · Двукислотные (гидроксид меди(II) Cu(OH)2) · Трехкислотные (гидроксид железа(III) Fe(OH)3) · По летучести. · Летучие: NH3, CH3-NH2 · Нелетучие: щёлочи, нерастворимые основания. · По стабильности. · Стабильные: гидроксид натрия NaOH, гидроксид бария Ba(OH)2 · Нестабильные: гидроксид аммония NH3·H2O (гидрат аммиака). · По степени электролитической диссоциации. · Сильные (α > 30 %): щёлочи. · Слабые (α < 3 %): нерастворимые основания. · По наличию кислорода. · Кислородсодержащие: гидроксид калия KOH, гидроксид стронция Sr(OH)2 · Бескислородные: аммиак NH3, амины. · По типу соединения: · Неорганические основания: содержат одну или несколько групп -OH. · Органические основания: органические соединения, являющиеся акцепторами протонов: амины, амидины и другие соединения. ]Номенклатура По номенклатуре IUPAC неорганические соединения, содержащие группы -OH, называются гидроксидами. Примеры систематических названий гидроксидов: · NaOH — гидроксид натрия · TlOH — гидроксид таллия(I) · Fe(OH)2 — гидроксид железа(II) Если в соединении есть оксидные и гидроксидные анионы одновременно, то в названиях используются числовые приставки: · TiO(OH)2 — дигидроксид-оксид титана · MoO(OH)3 — тригидроксид-оксид молибдена Для соединений, содержащих группу O(OH), используют традиционные названия с приставкой мета-: · AlO(OH) — метагидроксид алюминия · CrO(OH) — метагидроксид хрома Для оксидов, гидратированных неопределённым числом молекул воды, например Tl2O3• n H2O, недопустимо писать формулы типа Tl(OH)3. Называть такие соединениями гидроксидами также не рекомендуется. Примеры названий: · Tl2O3• n H2O — полигидрат оксида таллия(III) · MnO2• n H2O — полигидрат оксида марганца(IV) Особо следует именовать соединение NH3•H2O, которое раньше записывали как NH4OH и которое в водных растворах проявляет свойства основания. Это и подобные соединения следует именовать как гидрат: · NH3•H2O — гидрат аммиака · N2H4•H2O — гидрат гидразина Химические свойства · В водных растворах основания диссоциируют, что изменяет ионное равновесие:
это изменение проявляется в цветах некоторых кислотно-основных индикаторов: · лакмус становится синим, · метилоранж — жёлтым, · фенолфталеин приобретает цвет фуксии. · При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
Примечание: реакция не идёт, если и кислота и основание слабые. · При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
· Амфотерные основания могут реагировать с щелочами с образованием гидроксокомплексов:
· Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
· Основания вступают в обменные реакции (реагируют с растворами солей):
· Слабые и нерастворимые основания при нагреве разлагаются на оксид и воду:
Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре. · Основания щелочных металлов (кроме лития) при нагревании плавятся, расплавы являются электролитами.
Основания – сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп.Общая формула оснований Ме(ОН) n. Основания (с точки зрения теории электролитической диссоциации) – это электролиты, диссоциирующие при растворении в воде с образованием катионов металла и гидроксид-ионов ОН–. Классификация. По растворимости в воде основания делят на щелочи (растворимые в воде основания) и нерастворимые в воде основания. Щелочи образуют щелочные и щелочно-земельные металлы, а также некоторые другие элементы-металлы. По кислотности (числу ионов ОН–, образующихся при полной диссоциации, или количеству ступеней диссоциации) основания подразделяют на однокислотные (при полной диссоциации получается один ион ОН–; одна ступень диссоциации) и многокислотные (при полной диссоциации получается больше одного иона ОН–; более одной ступени диссоциации). Среди многокислотных оснований различают двухкислотные (например, Sn(OH)2), трехкислотные (Fe(OH)3) и четырехкислотные (Th(OH)4). Однокислотным является, например, основание КОН. Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды ( см. таблицу 1).
Таблица 1 - Амфотерные гидроксиды
Физические свойства. Основания - твердые вещества различных цветов и различной растворимости в воде.
|