Химическое равновесие
Химические реакции бывают обратимые и необратимые. Необратимые протекают только в одном направлении, в сторону образования продуктов реакции до полного расходования исходных веществ. Обратимые реакции одновременно протекают в двух взаимно противоположных направлениях. Такие реакции не доходят до конца ни в одном из направлений, ни одно из реагирующих веществ не расходуется полностью. Состояние системы, характеризующееся одновременным протеканием с одинаковыми скоростями двух противоположно направленных химических процессов, называется химическим равновесием. В состоянии равновесия концентрации всех веществ остаются неизменными. Признаки химического равновесия: ˗ состояние системы неизменно во времени при отсутствии внешних воздействий; ˗ состояние системы изменяется под влиянием внешних воздействий, сколь бы малы они ни были; через некоторое время в такой системе вновь устанавливается равновесие, но уже при другом соотношении равновесных концентраций всех веществ; ˗ состояние системы не зависит от того, с какой стороны она подходит к равновесию (со стороны прямой или обратной реакции); ˗ при снятии внешнего воздействия система вновь возвращается в исходное состояние. В изобарно-изотермических условиях (P; T=const) при равновесии изменение энергии Гиббса системы равно нулю (DG =0). Рассмотрим условную обратимую реакцию aA+bB ⇄ cC+dD.
Закондействующих масс для нее запишется в виде:
где К – константа равновесия; [A], [ B ], [ C ], [ D ] – равновесные концентрации веществ; a, b, c, d – стехиометрические коэффициенты в уравнении реакции. Константа равновесия зависит от температуры и природы веществ, но не зависит от их концентрации Чем больше величина константы равновесия, тем в большей степени равновесие смещено в сторону образования продуктов реакции. Таким образом, константа равновесия характеризует глубину протекания процесса к моменту равновесия. Для реакций с участием газов константу равновесия (Кр)можно выразить и через парциальные давления газообразных веществ. Если газы не сильно отличаются по свойствам от идеальных, то между константой, выраженной через парциальные давления (Кр), и константой, выраженной через концентрации (Кс), существует связь: Kp=Kc×(RT)Dn, (2.2.2) где Dn– изменение числа моль газообразных веществ в ходе реакции в соответствии с ее стехиометрией. Константа равновесия при температуре Т связана с изменением стандартной энергии Гиббса реакции DG0 при той же температуре соотношением DG0= - RT×lnK. (2.2.3) Следует отметить, что в формуле (2.2.3) фигурирует, так называемая, термодинамическая константа равновесия, которая является безразмерной величиной, выражаемой через относительные парциальные давления газообразных компонентов:
Относительное парциальное давление рассчитывается как отношение парциального давления компонента к стандартному атмосферному давлению:
Только термодинамическая константа равновесия может быть вычислена через термодинамические функции. Связь между К, КP и КС:
где
Уравнение изотермы химической реакции:
Зависимость константы равновесия от температуры. Уравнение изобары химической реакции в интегральной форме:
В гетерогенных реакциях концентрация конденсированной фазы практически постоянна, она в неявной форме входит в константу равновесия. В выражение для константы равновесия концентрации конденсированной фазы не включаются. При изменении внешних условий равновесие смещается потому, что эти изменения по-разному влияют на скорости прямой и обратной реакций. Равновесие смещается в сторону той реакции, скорость которой становится больше. На равновесие влияет изменение температуры, концентрации веществ, давления в системе (если реакция идет с изменением числа моль газообразных веществ). Введение катализатора не смещает равновесие, так как он в равной мере изменяет скорость как прямой, так и обратной реакции. Катализатор лишь сокращает время достижения системой состояния равновесия. В общем случае направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится в том направлении, которое ослабляет это воздействие.
|


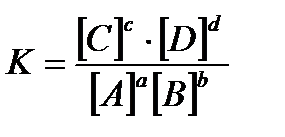 , (2.2.1)
, (2.2.1) . (2.2.4)
. (2.2.4) .
.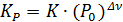 ,
, 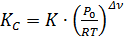 , (2.2.5)
, (2.2.5)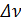 – изменение числа моль газообразных веществ в ходе реакции, то есть
– изменение числа моль газообразных веществ в ходе реакции, то есть
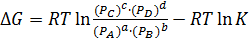 (2.2.6)
(2.2.6)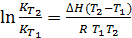 (2.2.7)
(2.2.7)


