Марганец – кислая среда
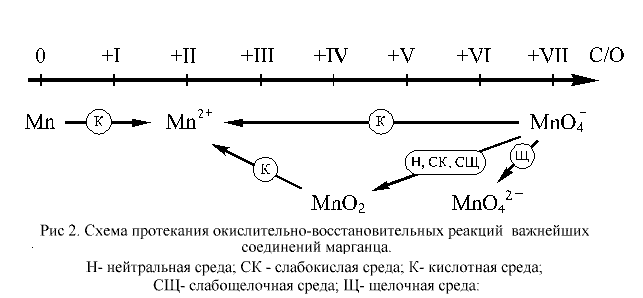
21. NaCIO + CrCI3 + NaOH = 21. = NaCI + NaCrO4 + H2O. Производные высших степеней окисления марганца (+7) восстанавливаются до марганца(II): 2МnО4‾ +10Сl‾ + 8Н+ = 2Mn2+ + 5Cl2↑ + 4Н2О. Для марганца известны соединения, в которых он проявляет все возможные степени окисления: от нуля до +VII. В ОВР, протекающих в растворах, чаще всего участвуют соединения марганца в степенях окисления +II, +IV, +VII и, отчасти, +VI. Соединения марганца(II) проявляют слабо выраженные восстановительные свойства. Соединения, содержащие марганец в степенях окисления +IV, +VI и +VII, – более или менее сильные окислители. Наиболее сильными окислителями являются соединения марганца в степени окисления +VII. Металлический марганец – довольно активный восстановитель
Технеций — элемент побочной подгруппы седьмой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 43. Обозначается символом Tc. Простое вещество технеций — радиоактивный переходный металл серебристо-серого цвета. Самый лёгкий элемент, не имеющий стабильных изотопов. Первый из синтезированных химических элементов. Технеций — радиоактивный переходный металл серебристо-серого цвета с гексагональной решёткой. По химическим свойствам технеций близок к марганцу и рению, в соединениях проявляет степени окисления от −1 до +7. При взаимодействии с кислородом образует оксиды Tc2O7 и TcO2, с хлором и фтором — галогениды TcX6, TcX5, TcX4, с серой — сульфиды Tc2S7 и TcS2. Технеций входит в состав координационных и элементоорганических соединений. В ряду напряжений технеций стоит правее водорода, не реагирует с соляной, но легко растворяется в азотной и серной кислотах. Рений - химический элемент с атомным номером 75. При стандартных условиях представляет собой плотный серебристо-белый металл. Рений — тугоплавкий тяжёлый металл, по внешнему виду напоминает сталь. Порошок металла — чёрного или темно-серого цвета в зависимости от дисперсности. По температуре плавления рений занимает второе место среди металлов, уступая лишь вольфраму, а по плотности — четвёртое (после осмия, иридия и платины). По температуре кипения стоит на первом месте среди химических элементов. Компактный рений устойчив на воздухе при обычных температурах. При температурах выше 300°C наблюдается окисление металла, интенсивно окисление идет при температурах выше 600°C. Рений более устойчив к окислению, чем вольфрам, не реагирует непосредственно с азотом и водородом; порошок рения лишь адсорбирует водород. При нагревании рений взаимодействует с фтором, хлором и бромом. Рений почти не растворим в соляной и плавиковой кислотах и лишь слабо реагирует с серной кислотой даже при нагревании, но легко растворяется в азотной кислоте. Со ртутью рений образует амальгаму. Рений взаимодействует с водными растворами пероксида водорода с образованием рениевой кислоты.
|