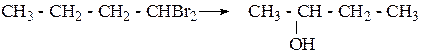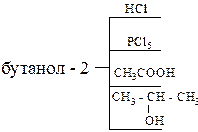Лабораторная работа. Цель работы: Изучение химических свойств спиртов.
Цель работы: Изучение химических свойств спиртов. Реактивы и оборудование: 2н. H2SO4; 0,5н. K2Cr2O7; 2н. KMnO4; 2н. NaOH; 0,2н. CuSO4; 2,4-динитрофенилгидразин; глицерин, фенолфталеин, 1%-ный спиртовый раствор; этанол; натрий металлический; ацетат натрия (обезв.). штатив с пробирками; держателль для пробирок; скальпель; пинцет; фильтровальная бумага; спиртовка. Опыт 4.1 Получение этилата натрия Помещают в пробирку маленький кусочек металлического натрия (кубик 2х2х2 мм). Добавляют 3 капли этанола и закрывают отверстие пробирки пальцем. Что наблюдается? По окончании реакции, не отрывая пальца от отверстия пробирки, подносят ее к пламени спиртовки. При открытии пробирки водород воспламеняется, образуя маленькое колечко голубоватого цвета. На дне пробирки остается беловатый осадок этилата натрия. От прибавления 2-3 капель воды осадок растворяется (примечание 1). При добавлении 1 капли фенолфталеина раствор окрашивается? Почему? Примечание 1. Иногда наблюдается очень незначительная вспышка за счет ничтожных остатков непрореагировавшего натрия, если его было взято больше, чем надо. Опыт 4.2 Реакция глицерина с гидратом окиси меди в щелочной среде Помещают в пробирку 3 капли 0,2н. CuSO4, 3 капли 2н. NaOH и взбалтывают. Что при этом наблюдается? Полученный раствор нагревают. Что при этом происходит и почему? Опыт повторяют, но перед кипячением гидроксида меди добавляют в пробирку 1 каплю глицерина. Полученный раствор нагревают на пламени спиртовки. Сравнить наблюдаемые эффекты и дать их объяснение. Выводы подтвердить уравнениями химических реакций. Опыт 4.3 Окисление этанола хромовой смесью Помещают в пробирку 2 капли этанола и добавляют 1 каплю 2н H2SO4 и 2 капли 0,5н. K2Cr2O7. Полученный оранжевый раствор нагревают над пламенем микрогорелки до начала изменения цвета. Обычно уже через несколько секунд цвет раствора становится синевато-зеленым (цвет солей оксида хрома (III)). Одновременно ощущается характерный запах этаналя. Для подтверждения его образования в пробирку с каплей полученного раствора вводят 3 капли этанола и 3 капли раствора 2,4-динитрофенилгидразина. Образование альдегида подтверждается выпадением оранжевого осадка. Написать уравнение реакции. Опыт 4.4 Получение диэтилового эфира В сухую пробирку помещают 2 капли этанола и 2 капли концентрированной серной кислоты. Пробирку осторожно нагревают до начала незначительного побурения раствора. Образование диэтилового эфира можно обнаружить по характерному запаху. К горячей смеси добавляют еще 2 капли этанола. Без дополнительного нагревания образуется новая порция диэтилового эфира, запах его становится более заметным. Сравните его с запахом готового диэтилового эфира. Опыт 4.5 Получение этилового эфира этановой кислоты В сухую пробирку помещают немного (высота слоя около 2 мм) порошка обезвоженного ацетата натрия и 3 капли этанола. Добавляют 2 капли концентрированной серной кислоты (в вытяжном шкафу) и осторожно нагревают над пламенем спиртовки. Через несколько секунд появится характерный приятный освежающий запах уксусноэтилового эфира. Напишите уравнение реакций.
Вопросы для контроля 1. Определение, классификация и номенклатура спиртов. 2. Способы получения спиртов. 3. Особенности строения и химические свойства спиртов. 4. Окисление спиртов. 5. Качественные реакции на двух- и трехатомные спирты.
Упражнения по теме «Спирты» 1. Напишите структурные формулы первичных, вторичных спиртов состава С6Н15ОН и назовите их. 2. Напишите структурные формулы непредельных спиртов состава С4Н7ОН, С5Н9ОН и назовите их по систематической номенклатуре. 3. Получите гидратацией соответствующих алкенов следующие спирты: 3,3-диметилбутанол-2, 2-метилпентанол-2, 3-метилгексанол-2. 4. С помощью каких реакций можно осуществить превращения:
5. Получите спирты, исходя: а) из метаналя и бромистого изопропилмагния; б) из этаналя и втор-бутилмагния. 6. Напишите схемы синтеза бутанола-2: а) из галогеналкила; б) из алкена; в) магнийорганическим синтезом. 7. Используя в качестве исходного вещества ацетилен получите бутанол-2. 8. Используя магнийорганический синтез, получите 2-метилпентанол-3. Дегидратируйте его. Продукт дегидратации окислите разбавленным водным раствором KMnO4. 9. Глицерин получите из пропилена и напишите для глицерина реакции с уксусной и азотной кислотами. 10. Напишите структурную формулу вещества состава С4Н8О, если известно, что оно обесцвечивает бромную воду, реагирует с металлическим натрием с выделением водорода, а при осторожном окислении образует бутен-3-аль. 11. Определите молекулярный вес одноатомного спирта при дегидратации 28,8 г которого выделилось 3,6 г воды. 12. Напишите следующие реакции:
13. Какие спирты образуются в результате щелочного гидролиза: а) 2-бромпропана; б) 1,4-дибромбутана; в) 3-хлорбутена-1? 14. Как получить 2-метилбутанол-2 из 2-метилбутанол-1? 15. Напишите схему синтеза бутанол-2 из этана.
Фенолы
Органические соединения, содержащие гидроксильную группу, связанную непосредственно с бензольным ядром, называют фенолами: в зависимости от числа гидроксильных групп в ядре различают одно-, двух- и трехатомные фенолы. Химические свойства фенолов определяются гидроксильной группой и связанным с ней бензольным ядром. Сопряжение неподеленной пары электронов атома кислорода гидроксильной группы с p-электронной системой бензольного кольца приводит к смещению электронной плотности в сторону кольца (+М – эффект). В результате связь О – Н становится сильно поляризованной и атом водорода гидроксильной группы легко отщепляется в виде протона с образованием фенолят – иона:
Такое электронное смещение в фенолят-ионе объясняет его повышенную устойчивость. Поэтому фенолы значительно превосходят по кислотным свойствам алифатические спирты (фенолы реагируют со щелочами). +I-эффект гидроксильной группы приводит к значительному повышению электронной плотности в орто- и пара- положениях, что значительно облегчает реакции электрофильного замещения (SЕ). Введение в бензольное ядро электроноакцепторных заместителей (нитрогруппы, атомов галогенов и др.) приводит к увеличению кислотных свойств фенола.
|