Образование осадков. Влияние различных факторов на полноту осажденияРастворимость осаждаемого соединения Очевидно, что при прочих равных условиях всякое отделение будет тем более полным, чем менее растворимо то соединение, в виде которого осаждается данный ион. Например, катионы Ba2 + можно осаждать из анализируемого раствора в виде сульфатов, хроматов, карбонатов и оксалатов. Произведения растворимости этих соединений равны:
При прочих равных условиях осаждение Ba2+ будет тем полнее, чем менее растворимо соединение, в виде которого осаждается данный ион. Из приведенных значений KS можно сделать вывод, что наименее растворим BaSO4, поэтому наиболее полным будет осаждение в виде этого соединения. Влияние осадителя Казалось, чтобы достичь полного осаждения того или иного иона, надо прибавить эквивалентное по уравнению реакции количество осаждающего иона (осадителя). На самом деле, если растворимость и произведение растворимости осадка не очень малы, то эквивалентного количества осадителя оказывается недостаточно. Над осадком, в пределах произведения растворимости остается еще некоторая концентрация неосажденного иона. Для практически полного осаждения иона в виде соединения, заметно растворимого в воде, нужно добавить избыток осаждающего реактива. Установлено, что при этом лучше всего брать полуторный избыток осадителя. Добавление большего избытка осадителя может не только способствовать полноте осаждения иона, но и, наоборот, часто вызывает растворение осадка. Например, при осаждении Ca2 + в виде сульфата кальция по реакции:
нужно избегать большого избытка (NH4)2SO4, т. к. может происходить растворение осадка за счет образования растворимой комплексной соли:
Повышение растворимости осадков при добавлении большого избытка осадителя может быть также обусловлено амфотерностью осаждаемых гидроксидов Al(OH)3, Zn(OH)2 и т. д.
Кроме того, приливаемый избыток осадителя вызывает солевой эффект. Значение рН раствора Значение рН раствора существенным образом может влиять на полноту осаждения. Особенно заметно это влияние при осаждении малорастворимых гидроксидов, а также солей слабых и сильных кислот. Рассмотрим это влияние на примере осаждения малорастворимых гидроксидов. Здесь осадителем является ОН- - ион. От концентрации [ОН-] зависит, выпадет ли осадок гидроксида и будет ли его осаждение практически полным. При осаждении гидроксида очень важно знать рН начала осаждения (рНн.о.) и рН конца осаждения (рНк.о.) Пример. Рассчитать рНн.о. и рНк.о. Mg(OH)2 из 0,01 М раствора Mg2+. Решение. Из величины
Следовательно,
Для расчета рН конца осаждения исходят из того факта, что осаждение считается полным тогда, когда концентрация осаждаемого иона (в данном случае Mg2+) понизится до 10 -5 – 10 -6 моль/л. Следовательно, концентрация [ОН - ] в конце осаждения равна
Если рН> 12,4, то осаждение Mg2+ будет еще более полным, а при рН< 12,4 осаждение будет неполным, при рН < 10,4 Mg2+ не будет осаждаться совсем. Теоретически вычисленные значения рН н.о. и рН к.о в большинстве случаев совпадают с опытными достаточно удовлетворительно, хотя на практике приходится сталкиваться с достаточно большим числом факторов, влияющих на осаждение, в том числе на присутствие в растворе других ионов, способных к осаждению в данных условиях, и т. д. Часто используют для регулирования рН в процессе осаждения различные буферные смеси, способные поддерживать постоянным значение рН в процессе осаждения в заданном интервале.
5.Дробное осаждение. Перевод одних малорастворимых Нередко прибавляемый реагент образует малорастворимое соединение не с одним, а с двумя или несколькими ионами, находящимися в растворе. Используя правило произведения растворимости, можно понять, как происходит осаждение ионов в подобных случаях. Допустим, что в растворе одновременно присутствуют катионы Ca2+ и Ba2+, их концентрации равны 10-1 моль/л. При постепенном прибавлении к этой смеси раствора оксалата аммония (NH4)2C2O4 возможно течение двух реакций:
Первым выпадает в осадок то соединение, для которого раньше будет достигнута (и превышена) величина произведения растворимости. Исходя из значений KS, можно вычислить, какие концентрации иона
Из приведенных расчетов видно, что для осаждения оксалата кальция требуется значительно меньшая концентрация оксалат-иона (2,6. 10 -8 моль/л), чем для оксалата бария (1,6. 10 -6 моль/л). Следовательно, из смеси будет первым осаждаться оксалат кальция, для которого произведение растворимости достигается раньше. Таким образом, осаждение ионов из их смеси происходит в той последовательности, в какой достигаются произведения растворимости малорастворимых электролитов, образующихся при действии того или иного реактива. Такое последовательное осаждение называется фракционированным (или дробным).
6. Превращение одних малорастворимых соединений В аналитической химии часто приходится иметь дело с реакциями, в которых одно малорастворимое соединение переводят в другое, еще менее растворимое в данных условиях. Например, осадок SrSO4 Это имеет большое практическое значение, т. к. SrSO4 не растворяется в кислотах, а SrCO3 – растворим. Поэтому, чтобы перевести SrSO4 в раствор, его сначала превращают в карбонат, а затем растворяют в кислотах. Если сопоставить произведения растворимости BaSO4 Превращение BaSO4 в BaCO3 должно происходить при условии
т. е.
Таким образом, чтобы превращение BaSO4 в BaCO3 происходило, надо, чтобы На практике для более полного перевода осадка осуществляют многократное действие свежей порцией раствора Na2CO3 на осадок, сливая при этом жидкость с осадка. Процессы превращения одних малорастворимых соединений в другие могут быть с успехом использованы для разделения ионов, особенно при их дробном обнаружении.
|

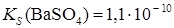 ;
; 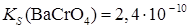 ;
; 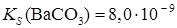 ;
; 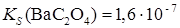 .
.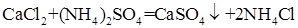

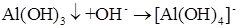
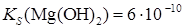 легко рассчитать концентрацию [ОН-] - иона, при которой достигается произведение растворимости и начинается осаждение Mg(OH)2:
легко рассчитать концентрацию [ОН-] - иона, при которой достигается произведение растворимости и начинается осаждение Mg(OH)2: ;
;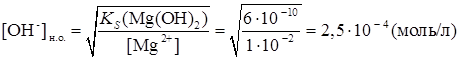 .
.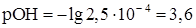 ;
;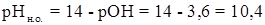 .
.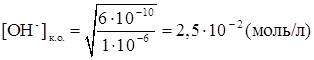 ;
;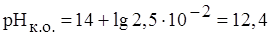 .
.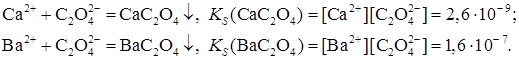
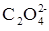 необходимы для начала осаждения оксалата кальция и бария:
необходимы для начала осаждения оксалата кальция и бария: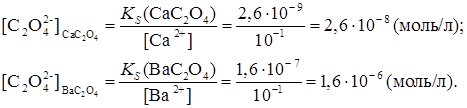
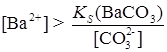 .
.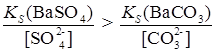 ,
,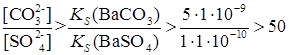 .
. в растворе превышала
в растворе превышала  более, чем в 50 раз.
более, чем в 50 раз.


