Оксид азота V, азотная кислота и ее соли - нитратыОксид азота (V) − N2O5, азотная кислота и ее соли (ион NO-3) являются производными четырех ковалентного иона N+. Азот находится в sр2-гибридизации и образует нелокализованные химические связи. Оксид азота V (азотный ангидрид) - белое кристаллическое вещество, получается осторожным обезвоживанием НNO3 (например, с помощью Р2О5) 2HNO3+Р2O5=N2O5+2HРO3. N2O5 − неустойчив и при обычных условиях медленно разлагается: 2N2O5=2N2O4+O2. При растворении в воде образует азотную кислоту HNO3.Азотная кислота HNO3 − бесцветная жидкость, кипящая при 84,1 °С, а при -41,6 °С - затвердевающая в прозрачную кристаллическую массу. С водой смешивается в любых соотноше-ниях, является сильной кислотой. В лаборатории получают действием концентри-рованной серной кислоты на нитрат натрия: NaNO3+2H2SO4=Na2SO4+2HNO3. Промышленное производство НN03 осуществляется по стадиям: NH3 --- NO --- NO2 ----HNO3. Азотная кислота является сильным окислителем. Она разрушает животные и растительные ткани, окисляет почти все металлы и неметаллы. Образование тех или иных продуктов взаимодействия зависит от концентрации HN03, активности простого вещества и температуры. Концентрированная азотная кислота взаимодействует со многими неметаллами: при кипячении сера окисляется ею до H2SO4, уголь до СО2:
6 NO3ˉ +2H++ е = NO2+ H2O S+ 4H2O + 6NO3ˉ+12H+ = SO42ˉ+8Н+ + 6NO2+ 6H2O
C+4HNO3=CO2+4NO2+2H2O. Более разбавленная кислота восстанавливается до NО: 3Р+5HNO3+2H2O=3H3РO4+5NO
5 NO3ˉ +4H++ 3е = NO+ 2H2O 3Р +12H2O +5NO3ˉ +2ОH+ = 3Н3РO4+15Н++ 5NO+ 10H2O. Концентрированная НNО3 не действует на золото и платину, железо и алюминий, некоторые другие металлы пассивируются азотной кислотой, так как на поверхности образуется защитная оксидная пленка. Концентрированная азотная кислота, взаимодействуя с тяжелыми металла-ми, восстанавливается до NO2, а со щелочными и щелочноземельными – до N2O, например: Cu+4HNO3конц=Cu(NO3)2+2H2O+2NO2
2 NO3ˉ +2H++ е = NO2+ H2O Cu + 2NO3ˉ + 4H+ = Cu2++ 2NO2+ 2H2O. Глубина восстановления азота в разбавленной азотной кислоте зависит от ак-тивности металла:
3Cu+8HNO3разб=3Cu(NO3)2+2NO+4H2O 3 Cu –2е= Cu2+ 2 NO3ˉ +4H++ 3е = NO+ 2H2O 3 Cu +2NO3ˉ +8H+ = 3Cu2+ +2NO2+ 4H2O
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O 4 Mg –2е= Mg2+ 1 NO3ˉ +10H++ 8е = NH4+ + 3H2O 4Mg + NO3ˉ +10H+= 4Mg2+ + NH4+ + 3H2O.
Смесь концентрированной азотной кислоты с концентрированной соляной кислотой в соотношении I: 3 называется "царской водкой", на растворяет золото и платину: Au+HNO3+3HCl=H[AuCl4]+NO+2H2O 1 Au –3е + 4CI¯= [AuCl4]¯ 1 NO3ˉ +4H+ +3е = NO+ 2H2O Au + 4CI¯+ NO3ˉ +4H+ = [AuCl4]¯+NO+ 2H2O. Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности. Ее широко применяют для получения удобрений, бездымного пороха, взрывчатых веществ, например, нитроглицерина, динамита, красителей пластических масс. Нитраты − соли азотной кислоты, твердые кристаллические вещества белого цвета, хорошо растворимые в воде. Соли, образованные щелочными и щелочноземельными металлами, называются селитрами. Нитраты − довольно устойчивые соединения, разлагаются только при нагревании. Соли активных металлов разлагаются, превращаясь в нитриты: 2KNO3 Нитраты металлов, расположенных в ряду напряжений правее магния, (включая медь), разлагаются с образованием оксидов металлов: 2Рb(NO3)2 Нитраты ртути и серебра разлагаются с образованием свободных металлов: 2AgNO3 Водные растворы нитратов почти не обладают окислительными свойствами. Нитраты тяжелых металлов используются в основном для получения оксидов металлов, а селитры − в качестве азотных удобрений. Из аммонийной селитры приготавливают взрывчатые смеси − аммоналы.
|

 S+6HNO3=H2SO4+6NO2+H2O S+ 4H2O – 6е =SO42ˉ+8Н+
S+6HNO3=H2SO4+6NO2+H2O S+ 4H2O – 6е =SO42ˉ+8Н+ 3 Р +4H2O –5е = Н3РO4+5Н+
3 Р +4H2O –5е = Н3РO4+5Н+ 1 Cu –2е= Cu2+
1 Cu –2е= Cu2+
 Активные металлы NH4NO3
Активные металлы NH4NO3 HNO3разб Металлы средней активности N2O (N2)
HNO3разб Металлы средней активности N2O (N2) Неактивные металлы NO
Неактивные металлы NO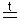 2KNO2+O2.
2KNO2+O2.


