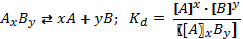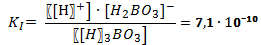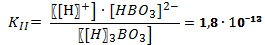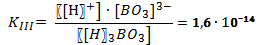Основные способы получения кислот1. Бескислородные кислоты можно получить из простых веществ. H2 + Cl2 H2 + S 2. Кислородсодержащие кислоты можно получить гидратацией соответствующих кислотных оксидов. N2O5 + H2O → 2HNO3 SO3 + H2O → H2SO4 3. Получение кислот вытеснением слабых кислот сильными, летучих – нелетучими, растворимых – нерастворимыми. Например, сильная соляная кислота вытесняет слабую уксусную из растворов их солей. СH3COONa + HCl = CH3COOH + NaCl NaСl (тв.) + H2SO4= NaНSO4 + HCl↑ 4. Кислоты можно получить при гидролизе некоторых солей или галогенидов. Al2 S3 +6 H2O → 2Al (OH)3↓+ 3H2S↑ PCl5 + H2O → H3PO4 + 5HCl 4. Теории кислот и оснований
Рис. 4. Существует большое количество теорий кислот и оснований. Одна из первых – это появившаяся в конце XVIII века благодаря Антуану Лавуазье (рис. 4), согласно которой кислотные свойства связывались с наличием в веществе кислорода. Именно благодаря этой теории появилось название элемента №8 (кислород – рождающий кислоты). Но эта гипотеза очень быстро доказала свою несостоятельность, когда стал известен целый ряд кислот, не содержащих кислород, например галогеноводородные кислоты.
Рис. 5. Теория кислот и оснований Сванте Аррениуса (рис. 5). Она базируется на теории электролитической диссоциации. Согласно ей, кислоты – это вещества, образующие в водном растворе гидратированные ионы водорода и анионы кислотного остатка. А соответственно, основания – это вещества, диссоциирующие в водном растворе на катионы металла и анионы гидроксогруппы. Теория Брёнстеда и Лоури. Согласно этой теории, кислоты – это молекулы или ионы, которые в данной реакции являются донорами протонов, а основания – это молекулы или ионы, которые принимают протоны, т. е. акцепторы. В органической химии существует теория Льюиса (рис. 6). Кислота – это молекула или ион, имеющая вакантные валентные орбитали, вследствие чего они способны принимать электронные пары, например, ионы водорода, ионы металлов, некоторые оксиды, а также ряд солей. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонсодержащие кислоты рассматриваются, как частный случай класса кислот.
Рис. 6. Основание по теории Льюиса – это молекула или ион, способные быть донорами электронных пар: все анионы, аммиак, амины, вода, спирты, галогены. Пример реакции между кислотами и основаниями Льюиса. AlCl3+ Cl- → Cl4- Это взаимодействие лежит в основе галогенирования ароматических соединений. Теория Усановича (Рис. 7). В этой теории кислота – это частица, которая способна отщеплять катионы или присоединять анионы. Соответственно, основание наоборот. Этой теорией пользуются очень редко, потому что она получилась слишком общей. Согласно ей, любые взаимодействия с участием ионов можно свести к кислотно-основным. А это не очень удобно.
Рис. 7. 5. Константа диссоциации Для количественной характеристики того, как кислота диссоциирует на ионы, кроме понятия степени электролитической диссоциации используют понятие константа диссоциации. Константа диссоциации – это вид константы равновесия, которая показывает склонность некоторого большого объекта (кислоты, соли или комплексного соединения) обратимо диссоциировать с образованием более маленьких объектов. Константа диссоциации определяется как произведение концентраций ионов в степени их стехиометрических коэффициентов, делённое на недиссоциированную форму.
В случае диссоциации вещества с многовалентными ионами, диссоциация происходит ступенчато. Для каждой ступени существует собственное значение константы диссоциации. Пример диссоциации трехосновной борной кислоты H3BO3. I ступень: Н3ВО3 ↔ Н+ + Н2ВО3- I ступень: Н2ВО3- ↔ Н+ + НВО32- I ступень: НВО32- ↔ Н+ + ВО33- Выражение констант диссоциации по каждой из этих ступеней будет выглядеть так:
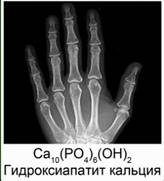
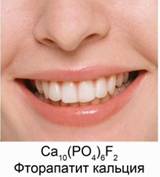
Из значения констант диссоциации делаем вывод, что многоосновные вещества в основном диссоциируют по первой ступени. 6. Неорганические кислоты в организме человека В организме человека большую роль играют три неорганических кислоты. Это – фосфорная кислота, угольная и соляная. Фосфорная кислота входит в состав буферных систем крови. Буферными называются такие растворы, которые при добавлении небольших количеств кислот или оснований изменяют свой водородный показатель рН. Эти системы нужны для того, чтобы поддерживать кислотность крови в определенном и довольно узком интервале. Остатки фосфорной кислоты входят в остатки многих биологически активных веществ, например нуклеиновых кислот и многих ферментов. Наши кости состоят из гидроксида фосфата кальция Сa10(PO4)6(OH)2 или гидроксиапатита кальция, а зубы включают в себя фторапатит кальция Сa10(PO4)6F2. Рис. 8.
Рис. 8. Угольная кислота также входит в состав буферных систем крови. За счёт действия легких такие системы можно быстро и легко регулировать и можно варьировать количество углекислого газа в крови. Соляная кислота содержится в желудочном соке. Она способствует денатурации и набуханию белков, что облегчает их последующее расщепление ферментами. Она создает кислую среду, необходимую для действия ферментов. Она ответственна за антибактериальную среду желудочного сока.
|

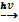 2HCl
2HCl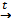 H2S
H2S