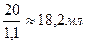Способы приготовления стандартных растворов.Растворы с известной концентрацией, которые служат для определения концентрации других растворов, называются стандартными или рабочими. Это некоторые растворы кислот, щелочей, солей. 1. Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают. Растворы точной навески можно приготовить лишь для немногих веществ. Эти вещества должны отвечать следующим требованиям: - чистое вещество - постоянный состав - устойчивость вещества на воздухе и в растворе. Такие соединения называются установочными. К ним относятся: щавелевая кислота (Н2С2О4 · 2Н2О), тетраборат натрия (бура) (Na2B4O7 · 12H2O), дихромат калия (K2Cr2O7). Для всех других веществ растворы готовят из неточной навески или разбавлением. 2. Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал - ампула с сухим веществом или раствором с точно известной концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным. 3. Метод приблизительной навески. Предполагает работу с растворами, которые меняют свою массу на воздухе, например, перманганат калия. Работать с такими растворами нельзя, поэтому перед применением их в качестве стандартных, необходимо оттитровать другим раствором с точно известной концентрацией. 4. Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного. 1.5.Решение задач на приготовление растворов с массовой долей (%) концентрации. Задача 1. Как приготовить 500 г раствора С6Н12О6 с массовой долей равной 10%? Дано: Решение: m (р-ра С6Н12О6) = 500 г ωС6Н12О6 = 10% 1. Определяем массу С6Н12О6 согласно __________________ формуле: m (в-ва) = Найти: m (С6Н12О6) =? m (С6Н12О6) = m (H2O) =? 2. Определяем массу воды согласно формуле: m (р-ра) = m (р-ля) + m (вещ-ва), m (Н2О) = m (р-ра) – m (в-ва), m (H2O) = 500 – 50 = 450 г. Согласно формуле: Ответ: чтобы приготовить 500 г раствора глюкозы с массовой долей 10%, необходимо отвесить на весах 50 г глюкозы, отмерить любой мерной склянкой 450 мл воды, поместить этот раствор в любую подходящую посуду и перемешать. Задача 2. Как приготовить 800 мл раствора NaCl с массовой долей равной 12% и плотностью равной 1,1 г/мл? Дано: Решение: V (р-ра) = 800 мл ω NaCl = 12 % ρ = 1,1 г/мл 1. Определяем массу р-ра NaCl согласно __________________ формуле: m (р-ра)=800 мл · 1,1г/мл = 880 г Найти: m (NaCl) =? m (H2O) =? 2. Определяем массу NaCl согласно формуле: m (в-ва) = m (NaCl) = 3. Определяем массу воды согласно формуле: m (Н2О) = m (р-ра) – m (в-ва),), m (Н2О) = 880 – 105,6 = 774,4 г или 774,4 мл, т.к. плотность воды равна 1 г/мл. Ответ: для приготовлшения 800 мл раствора хлорида натрия с массовой долей равной 12 %, необходимо отвесить на весах 105,6 г NaCl, отмерить любой мерной склянкой 774,4 мл воды, поместить все это в любую подходящую посуду и перемешать. Задача 3 Приготовить 100 г ра-ра MgSO4 c ω = 2 % из р-ра MgSO4 c ω = 10 %? Дано: Решение: ω1(MgSO4) = 10 % m2 (MgSO4) р-ра = 100 г ρ = 1,1 г/мл 1. Определяем массу чистого MgSO4 __________________ содержащегося в 100 г 2 % р-ра MgSO4 Найти: m 1 (MgSO4) =? m (в-ва) = m (H2O) =? m (MgSO4) = 2. Определяем массу р-ра MgSO4 (исходного) с ω = 10 % содержащего 2 г чистого MgSO4 3. Определяем объём исходного (первого) р-ра MgSO4 с ω = 10 % Vр-ра = 4. Определяем массу Н2О, которая необходима для разбавления исходного раствора MgSO4. m (H2O) = 100 – 20 = 80 г или для чистой воды 80 мл. Ответ: для приготовления 100 г раствора MgSO4 с массовой долей равной 2 % из раствора MgSO4 с массовой долей 10 % и ρ = 1,1 г/мл, необходимо отмерить из бюретки 18,2 мл 10 % р-ра MgSO4, поместить их в колбу, добавить туда цилиндром 80 мл воды и перемешать.
|

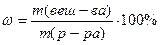
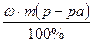
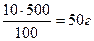
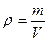 , где ρ – плотность раствора, m – масса раствора, V – объём раствора. Определяем V (H2O) =
, где ρ – плотность раствора, m – масса раствора, V – объём раствора. Определяем V (H2O) = 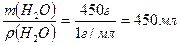 .
.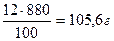
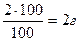
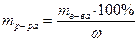 , m1(MgSO4) =
, m1(MgSO4) = 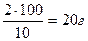
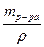 , Vр-ра (MgSO4) =
, Vр-ра (MgSO4) =