Задача. В реакции А ® В + С с общим порядком, равным единице, константа скорости k1 = 5×10-5 с-1В реакции А ® В + С с общим порядком, равным единице, константа скорости k 1 = 5×10-5 с-1. Определите концентрацию веществ А и В и скорость реакции через 1 час и через 5 часов, если начальная концентрация А составляла 0,2 моль/л.
Решение. Для реакции 1-го порядка справедливо уравнение где с – текущая концентрация вещества в момент времени τ;, с 0 – начальная концентрация, k – константа скорости, τ; – время.
Через 5 часов Концентрация вещества В находится по стехиометрическому соотношению веществ А и В. Из уравнения реакции следует, что концентрация вещества В возрастает на ту же величину, на какую убывает концентрация А, т. к. из 1 моль А получается 1 моль В. Поэтому через 1 час
Рассчитаем скорость реакции по уравнению: υ = k×с А
Через 5 часов
Задача. Для реакции первого порядка А ® 2В определите время, за которое прореагирует 90 % вещества А. Константа скорости реакции k 1 = 10-4 с-1. Решение. После превращения 90 % вещества А его концентрация составит 10% от начальной концентрации, т. е. 0,1 с 0.
Þ τ = ln 10/k1 = 23026 с = 6,4 ч. Задача. При изучении кинетики термического разложения ацетона, являющегося реакцией первого порядка, в соответствии с уравнением: СН3СОСН3(г) ® С2Н4(г) + СО(г) + Н2(г) получены следующие экспериментальные данные при Т = 802 К: давление в реакторе изменилось от начального р 0 = 312 мм. рт. ст. до 408 мм. рт. ст. за 390 с. Рассчитайте константу скорости реакции.
pi=ci×R×T или
Þ для реакции I-го порядка
Если р 0 – это начальное давление ацетона в реакционном сосуде, то для решения задачи необходимо определить парциальное давление этого вещества к моменту времени, когда общее давление
Из стехиометрии реакции видно, что 1 моль ацетона, распадаясь, образует 3 моль газа. Из закона Авогадро следует, что при уменьшении парциального давления ацетона на D р сумма парциальных давлений образовавшихся газов составит 3D р. Таким образом, можно записать P = p 0 – D p + 3×;D p или 408 = 312 + 2×;D p, D p = 48 мм рт.ст. Следовательно, парциальное давление ацетона через 390 с после начала опыта составило 312 – 48 = 264 (мм. рт. ст.).
После подстановки в уравнение получим:
Задача. При температуре 100 °С константа скорости реакции второго порядка 2НI(г) ® Н2(г) + I2(г) равна 8,83×10-16 л/(моль×с). Определите время полупревращения йодистого водорода, если начальная концентрация его равна 1 моль/л. Решение. Для реакции с n = 2:
Задача. В реакции второго порядка А + В ® D за 1 час концентрации веществ А и В уменьшились по сравнению с начальной с0А = с0В = 0,2 моль/л на 30 %. Определите константу скорости и скорость реакции в начальный момент времени и через час после начала реакции.
Решение. Концентрации веществ А и В за 1 час уменьшились на 0,3× с 0 = 0,06 моль/л. Отсюда, через час концентрации составят с А = с В = 0,2 – 0,06 = 0,14 (моль/л).
Þ
υ;0 = k II• c 0A• c 0B = 5,95∙ 10-4∙0,2∙0,2 = 1,38∙ 10-5 моль/(л∙с) Через 1 час: υ; = k II• c A• c B = 5,95∙ 10-4∙0,14∙0,14 = 1,16∙ 10-5 моль/(л∙с)
ЗАДАЧА. Рассчитайте изменение константы скорости реакции, имеющей энергию активации 191 кДж/моль, при увеличении температуры от 330 до 400 К.
Решение. Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса
или
Логарифм отношения констант скоростей реакции при температурах Т 2 и Т 1 соответственно равен где R = 8,31 Дж/(моль×К).
Вывод: при увеличении температуры на 70 К скорость реакции возросла в 100000 раз (!)
ПРИМЕР. Имеется раствор H3PO4 с массовой долей w = 30% и плотностью r = 1,18 г/см3. Вычислите сМ, с эк, Т, cm и χ H3PO4 в этом растворе. 1. Молярность -? Масса 1л раствора равна: m р-ра = r р-ра V р-ра = 1,18×1000 = 1180 г. В 1 л р-ра: m (H3PO4) = (m р-ра ∙ w)/100% = (1180×30)/100 = 354 г. M (H3PO4) = 98 г/моль. v (H3PO4)= m (H3PO4)/ M (H3PO4) =354/98 = 3,61 моль. Þ сМ = 3,61 моль/л, (3,61 М H3PO4). 2. Нормальность -? Э(H3PO4) =1/3 H3PО4, fэ (H3PO4) = 1/3 в 1 моле H3PО4 содержится 3 моль-эквивалента Þ в 1 л раствора 3,61×3 = 10,83 моль -экв Н3РО4.
с эк = 10,83 моль/л, (10,83 н H3PO4). 3. Титр -?
Т = 0,354 г/мл/ 4. Моляльность -? В 100 г раствора: 30 г Н3РО4 и 70 г Н2О. В 1000 г Н2О: m (H3PO4)= (1000×30)/70 = 428,5 г. v (H3PO4) = m (H3PO4)/ M (H3PO4) = 428,5/98 = 4,37 моля. Þ сm = 4,37 моль/1000 г Н2О. 5. Молярная доля -? В 1л раствора: m (H2O) = 1180 – 354 =826 г. v (H2O) = m (H2O)/ M (H2O) = 826/18 = 45,89 молей.
χ (H3PO4 ) = 0,073. ЗАДАЧА Р н.п. чистого ацетона(СО(СН3)2) при 20º С равно 23940 Па.
|

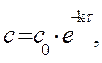
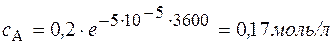
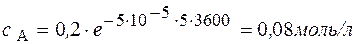 Через 1 час
Через 1 час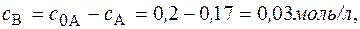
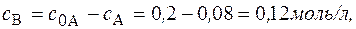 Через 5 часов
Через 5 часов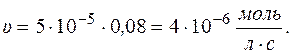
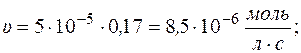 Через 1 час
Через 1 час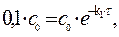
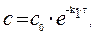 Из уравнения получим, что
Из уравнения получим, что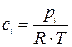 Решение. Все вещества в системе находятся в газообразном состоянии, и, учитывая условия проведения опыта, предполагаем, что они подчиняются законам идеальных газов. Следовательно, концентрация и парциальное давление газа связаны зависимостью
Решение. Все вещества в системе находятся в газообразном состоянии, и, учитывая условия проведения опыта, предполагаем, что они подчиняются законам идеальных газов. Следовательно, концентрация и парциальное давление газа связаны зависимостью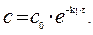
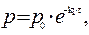
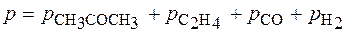 составило 408 мм. рт. ст.
составило 408 мм. рт. ст.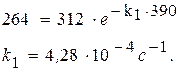
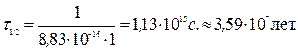
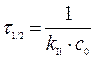
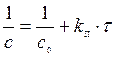 Для реакции II-го порядка
Для реакции II-го порядка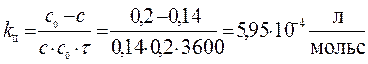
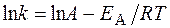
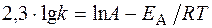
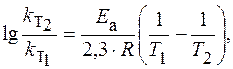
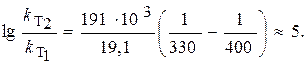
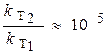

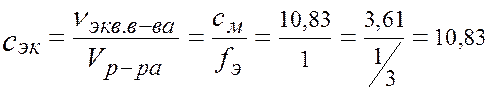 моль/л
моль/л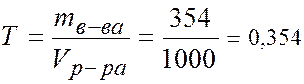 г/мл
г/мл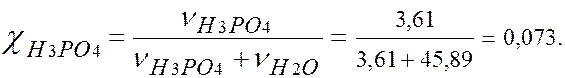
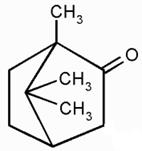 Р н.п. ацетона над раствором, содержащем 5 г камфоры на 200 г ацетона, при той же Т равно 23710 Па. Определите молекулярную массу камфоры.
Р н.п. ацетона над раствором, содержащем 5 г камфоры на 200 г ацетона, при той же Т равно 23710 Па. Определите молекулярную массу камфоры.


