Атом и атомное ядро. Опыты Резерфорда. Изотопы. Радиоактивность. Правила смещения.Класс Урок №36 Атом и атомное ядро. Опыты Резерфорда. Изотопы. Радиоактивность. Правила смещения. Сегодня мы приступаем к изучению последнего раздела физики 9 класса «Атомное ядро. Ядерная энергетика». Изучать этот раздел мы будем на протяжении 9 модулей, напишем 1 лабораторную работу, 1 контрольную работу и выставлено будет 1 т/о. Ядерная физика – это раздел физики, изучающий структуру и свойства атомного ядра, процессы, происходящие в нём, и механизмы его преобразования.
Изучение нового материала В переводе из греческой «атом» означает «неделимый». И, действительно, долгое время ученые считали атомы неделимыми «кирпичиками мироздания». Предусматривалось, что все вещества (а химикам были известны уже тысячи разных веществ) состоят из нескольких десятков разных типов атомов. Представление о неделимости атома оказалось под сомнением, когда в конце 19-го века английский физик Дж. Дж. Томсон открыл электрон. Масса электрона оказалась приблизительно в две тысячи раз меньше массы самого «лёгкого» атома, а это значило, что электроны каким-то образом входят в состав атомов, то есть атомы должны быть сложными объектами. Открытие электрона было одним из важнейших достижений физики конца 19-го века, и оно непосредственно связано с именем Томсона, отмеченного за него в 1906 году Нобелевской премией. В том же 1897 году, когда было зарегистрировано открытие электрона, Томсон обратился к проблеме атома. Он пришел к убеждению, что, вопреки своему названию, атом не является неделимым, Томсон предложил его модель. По этой модели атом выступал в виде положительно заряженной «капли», внутри которой «плавали» маленькие негативно заряжены шарики - электроны. Суммарный отрицательный заряд электронов равняется положительному заряду капли, потому атом в целом нейтрален.
Опыты, проведенные впоследствии в той же лаборатории наследником Томсона Э. Резерфордом заставили отказаться от этой модели в интересах «планетарной» модели, потому что Резерфорд открыл, что внутри атома есть очень малое ядро, в котором сосредоточена практически вся масса атома. В 1908-1911 гг. под его руководством были выполнены опыты из рассеивания
Схема опыта Резерфорда по рассеиванию Результаты опыта: 1) большинство 2) некоторые Резерфорд: «Это было так невероятно, будто вы выстрелили 15-дюймовым снарядом в лист папирусной бумаги, а снаряд вернулся назад и попал в вас». Какие бы выводы вы сделали из опыта Резерфорда? · В атоме есть пустоты; · · На основе этого сформировалась планетарная модель атома: 1. Весь атом состоит из положительно заряженного ядра, в котором сконцентрирована почти вся масса атома. Размеры ядра малы, его диаметр порядка 10-14-10-15м (диаметр атома 2. Вокруг массивного ядра по замкнутым орбитам двигаются лёгкие электроны, общий отрицательный заряд которых равняется положительному заряду ядра атома.
Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов. Совмещая знание по физике и химии выясним строение ядра атома: · Ядро состоит из положительно заряженных частиц (протонов-p) и нейтральных частиц (нейтронов-n), которые называются нуклонами. Их число отвечает массовому числу элемента в таблице Менделеева - А. · Порядковый номер в таблице Менделеева указывает на заряд ядра-количество протонов или количество электронов в атоме в нормальном состоянии - Z. · Нейтронов в атоме: N = A - Z. Ядра химических элементов обозначают символом Ядра одного и того же химического элемента могут отличаться числом нейтронов. Такие ядра называются изотопами. Изотопы – это вещества, имеющие различные физические свойства, но одинаковые химические. У большинства химических элементов есть несколько изотопов. Например, у водорода три изотопа: Химические элементы в естественных условиях обычно представляют собой смесь изотопов. Присутствие изотопов определяет значение атомной массы естественного элемента в периодической таблице Менделеева. Да, например, относительная атомная масса естественного углерода равняется 12,011. Домашнее задание Выучить параграф 31, записать в тетрадь конспект урока и выполнить упр. 28 № 1, №2, №3.
|

 Модель атома Дж. Томсона.
Модель атома Дж. Томсона. -частиц металлической фольгой.
-частиц металлической фольгой. 
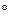 -150
-150  10-10 м).
10-10 м).

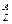 Х, где X – химический символ элемента. Например,
Х, где X – химический символ элемента. Например, 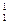 Н – водород,
Н – водород,  Не – гелий,
Не – гелий, 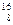 О – кислород,
О – кислород,  С – углерод,
С – углерод, 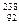 U – уран.
U – уран. Н – дейтерий и
Н – дейтерий и  Н – тритий. У углерода –6 изотопов, у кислорода –3.
Н – тритий. У углерода –6 изотопов, у кислорода –3.


