Реальные газы. Уравнение Ван-дер-ВаальсаВ 1873 г. голландский физик И. Ван-дер-Ваальс показал, что согласие результатов теории и эксперимента в области высоких давлений и низких температур оказывается значительно лучшим, если учесть, что молекулы не только отталкиваются при соударениях, но еще и притягиваются друг к другу сравнительно слабыми силами на расстояниях, сравнимых с размерами молекул. При движении молекулы вдали от стенок сосуда, в котором заключен газ, на нее действуют силы притяжения соседних с ней молекул, но равнодействующая всех этих сил в среднем равна нулю, так как молекулу со всех сторон окружает в среднем одинаковое число соседей. При приближении некоторой молекулы к стенке сосуда все остальные молекулы газа оказываются по одну сторону от нее и равнодействующая всех сил притяжения оказывается направленной от стенки сосуда внутрь газа. Это приводит к тому, что уменьшается импульс, передаваемый молекулой стенке сосуда В результате давление газа на стенки сосуда уменьшается по сравнению с тем, каким оно было бы в отсутствие сил притяжения между молекулами: р = рид - Dр, или рид = р + Dр. Уменьшение импульса, переданного молекулой при ударе о стенку, пропорционально силе притяжения, действующей на нее со стороны ее ближайших соседей, т. е. пропорционально концентрации молекул Полный же импульс, передаваемый всеми молекулами газа стенкам сосуда, в свою очередь пропорционален их концентрации. Поэтому вместо уравнения для идеального газа рид = nkT мы для реального газа получим: р + Dр = nkT. Поскольку сила, действующая на одну молекулу, пропорциональна концентрации окружающих ее молекул, а суммарное давление также пропорционально концентрации, то дополнительное давление Dр пропорционально квадрату концентрации или, что то же самое, обратно пропорционально квадрату объема газа: Dр = а /V2, где а — постоянная, зависящая от вида газа. Для одного моля газа получим:
|

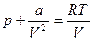 .
. Это первая поправка, вводимая в уравнение Ван-дер-Ваальса. Вторая поправка должна учесть тот факт, что при любых, даже сколь угодно больших давлениях объем газа не может стать равным нулю. В модели Ван-дер-Ваальса молекулы принимают за твердые шарики диаметром d. В этом случае оказывается, что молекулы реального свободно перемещаются не в объеме сосуда V, а в уменьшенном объеме: V= V – b. Здесь b - так называемый «запрещенный объем»; он равен
Это первая поправка, вводимая в уравнение Ван-дер-Ваальса. Вторая поправка должна учесть тот факт, что при любых, даже сколь угодно больших давлениях объем газа не может стать равным нулю. В модели Ван-дер-Ваальса молекулы принимают за твердые шарики диаметром d. В этом случае оказывается, что молекулы реального свободно перемещаются не в объеме сосуда V, а в уменьшенном объеме: V= V – b. Здесь b - так называемый «запрещенный объем»; он равен  , где N - общее число молекул газа. Получаем:
, где N - общее число молекул газа. Получаем: 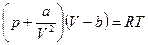 - уравнение Ван-дер-Ваальса для одного моля реального газа. График изотермы — кубическая парабола. Из рисунка видно, что одному значению давления р1 здесь соответствует три значения объема V1 V2 и V3.
- уравнение Ван-дер-Ваальса для одного моля реального газа. График изотермы — кубическая парабола. Из рисунка видно, что одному значению давления р1 здесь соответствует три значения объема V1 V2 и V3.


