Задание 2. Расщепление плазмидной ДНК эндонуклеазами рестрикции для ускоренного гидролиза ДНКИспользование эндонуклеаз рестрикции для ускоренного гидролиза ДНК позволяет значительно сократить время эксперимента, так как продолжительность ферментативной реакции составляет 5 мин (а не 1 – 3 часа, как при применении обычных рестриктаз). Буфер для проведения реакции универсален для всех ферментов, что делает возможным одновременное применение нескольких эндонуклеаз рестрикции. Для эффективного расщепления субстрата в этих условиях особенно важна качественная очистка препарата ДНК, которая может быть достигнута с использованием мини-колонок на основе кремния. Расщепление плазмидной ДНК проводят эндонуклеазами рестрикции фирмы «Fermentas» (Литва) в буферном растворе, поставляемом фирмой-изготовителем в 10-кратной концентрации. Ход работы: 1. Приготовить 1-ю реакционную смесь следующего состава (в тонкостенных пробирках типа «Eppendоrf» объемом 0,5 мл) при комнатной температуре: Состав смеси:
Компоненты следует добавлять в порядке, указанном в таблице. *) Если концентрация ДНК превышает 200 нг/мкл, то необходимо соответственно уменьшить объем раствора ДНК для рестрикции и увеличить объем воды
Состав смеси:
Компоненты следует добавлять в порядке, указанном в таблице. *) Если концентрация ДНК превышает 200 нг/мкл, то необходимо соответственно уменьшить объем раствора ДНК для рестрикции и увеличить объем воды
Электрофоретический анализ ДНК в агарозном геле.
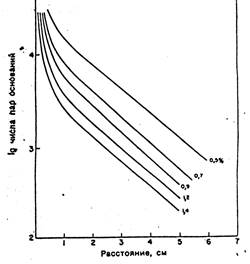
Рис.3 Зависимость пробега фрагмента ДНК от его размера при электрофорезе в агарозном геле Скорость миграции нуклеиновых кислот через агарозный гель зависит от ряда факторов. Скорость миграции в целом уменьшается при увеличении размеров фрагментов линейной ДНК (но лишь до определенного предела). Молекулы больше 30 000 п.н. не могут быть разделены обычным агарозным электрофорезом, так как такие фрагменты ДНК мигрируют практически с одинаковой скоростью независимо от их молекулярной массы. В области же эффективного разделения пройденное расстояние в геле (пробег) линейных двуцепочечных молекул ДНК обратно пропорционально десятичному логарифму их молекулярных масс. Фрагменты ДНК данного размера перемещаются в геле, содержащем разные концентрации агарозы, с разной скоростью. Чем выше концентрация агарозы, тем эффективнее разделение фрагментов меньшего размера, и наоборот. Зависимость эффективного разделения фрагментов ДНК разных размеров от концентрации агарозы в геле
Скорость миграции ДНК через агарозный гель при электрофорезе определяется также конформацией молекул. В суперспирализованной форме молекула ДНК наиболее компактна и обладает наибольшей подвижностью. Релаксированная форма (образующаяся при наличии хотя бы одного разрыва сахарофосфатной цепи в одной из цепей ДНК) имеет значительно меньшую электрофоретическую подвижность. При низких и средних концентрациях агарозы линейная ДНК той же молекулярной массы обладает промежуточной подвижностью между суперспирализованной и релаксированной формами. Скорость перемещения фрагментов линейной ДНК пропорциональна приложенному напряжению только при низких значениях напряженности электрического поля. При увеличении напряженности подвижность высокомолекулярных фрагментов дифференциально возрастает. При этом снижается область эффективного разделения ДНК в агарозном геле. Максимальное разделение фрагментов достигается при напряженности электрического поля, не превышающей 5 В/см. Для электрофореза ДНК обычно применяют буферы, содержащие трис-ацетат, трис-борат и трис-фосфат. Все три буферные системы обеспечивают хорошее разделение фрагментов в равной степени. Буферы для электрофореза ДНК обычно содержат хелатирующий агент ЭДТА для связывания двувалентных катионов Ca2+и Mg2+, что предотвращает распад ДНК под действием эндо- и экзонуклеаз, активность которых зависит от присутствия в среде этих катионов. Для наблюдения за ходом электрофореза в пробу добавляют лидирующие красители (бромфеноловый синий и ксиленцианол) до конечной концентрации примерно 0,04%. Для удобства нанесения образцов (для «утяжеления» проб) в них добавляют глицерин до конечной концентрации 5%. Наиболее удобным методом визуализации ДНК в агарозных гелях является окрашивание ее флуоресцирующим красителем бромистым этидием, который специфически интеркалирует между азотистыми основаниями в ДНК. Ультрафиолетовое излучение, поглощаемое ДНК в области 260 нм, передаваемое на краситель, а также излучение, поглощаемое самим красителем при 300 нм, испускается затем в красно-оранжевой области видимого спектра. Задание 3. Электрофорез в агарозном геле выделенной исходной и рестрицированной плазмидной ДНК Ход работы: 1. 1%-й агарозный гель остудить до температуры 50ºС. Перед заливкой геля тщательно проверить горизонтальность поверхности заливочного столика с помощью уровня; установить гребенку на подложку. Необходимо, чтобы между концом гребенки и подложкой оставался просвет 0,5 – 1 мм для формирования дна кармана. Во время процедуры заливки необходимо следить, чтобы в геле не было пузырьков воздуха. После того, как гель полностью затвердеет, осторожно вынуть гребенку и поместить гель в электрофорезную камеру (рис.4).
1. Добавить в камеру трис-ацетатный буфер (1х ТАЕ: 0,04 М трис-ацетат, рН 7,6, 0,002 М ЭДТА) так, чтобы гель был полностью покрыт буфером. 2. Приготовить пробы, содержащие выделенную суперспирализованную и рестрицированную плазмидную ДНК.
Состав проб:
*) Если концентрация плазмидной ДНК больше 200 нг/мкл, то объем раствора ДНК должен быть соответственно уменьшен, а объем буфера 1х ТАЕ увеличен 3. Нанести пробы в карманы геля под буфер с помощью автоматической пипетки. Кроме опытных проб на одну дорожку нанести маркер молекулярных масс (рис. 5) так, чтобы общее количество ДНК составило примерно 0,5 мкг. 4. 5. После того, как бромфеноловый синий пройдет примерно ¾ геля, выключить напряжение, гель поместить в кювету с раствором бромистого этидия (1 мкг/мл на 0,001 М ЭДТА). 6. Окрашивание проводить в течение 20 – 30 мин при комнатной температуре. Идентифицировать полосы в длинноволновом ультрафиолетовом свете можно, не снимая гель с подложки, так как она изготовлена из специального материала, свободно пропускающего ультрафиолетовый свет.
Рис.5. Электрофореграмма ДНК GeneRuler™ 1000 п.н. в 1%-м агарозном геле
|

 Электрофоретическое разделение нуклеиновых кислот и их фрагментов в полиакриламидных и агарозных гелях отличается от разделения белков рядом особенностей, обусловленных структурой этих биополимеров. В нейтральной и щелочной средах молекулы нуклеиновых кислот заряжены отрицательно, поскольку их заряд определяется диссоциацией фосфатных групп. Величина этого заряда мало зависит от рН окружающей среды, а отношение заряда к массе практически одинаково для всех нуклеиновых кислот. Таким образом, фракционирование идет за счет размеров и формы молекул. Для электрофоретического разделения полинуклеотидов используют эффект молекулярного сита, присущий полиакриламидным и агарозным гелям. Для фракционирования фрагментов ДНК размером меньше 100 пар нуклеотидов обычно используют полиакриламидные гели с разными концентрациями полиакриламида (3,5% – 20%). Более крупные молекулы ДНК разделяют в агарозном геле.
Электрофоретическое разделение нуклеиновых кислот и их фрагментов в полиакриламидных и агарозных гелях отличается от разделения белков рядом особенностей, обусловленных структурой этих биополимеров. В нейтральной и щелочной средах молекулы нуклеиновых кислот заряжены отрицательно, поскольку их заряд определяется диссоциацией фосфатных групп. Величина этого заряда мало зависит от рН окружающей среды, а отношение заряда к массе практически одинаково для всех нуклеиновых кислот. Таким образом, фракционирование идет за счет размеров и формы молекул. Для электрофоретического разделения полинуклеотидов используют эффект молекулярного сита, присущий полиакриламидным и агарозным гелям. Для фракционирования фрагментов ДНК размером меньше 100 пар нуклеотидов обычно используют полиакриламидные гели с разными концентрациями полиакриламида (3,5% – 20%). Более крупные молекулы ДНК разделяют в агарозном геле.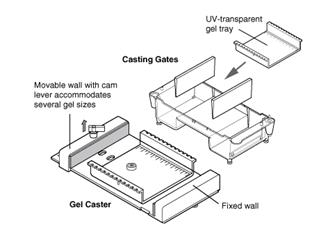 Рис. 4. Схема заливки геля
Рис. 4. Схема заливки геля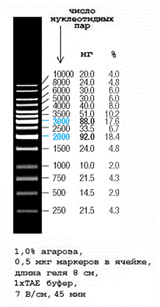 Включить напряжение. ДНК движется в электрическом поле от катода (-) к аноду (+). Напряженность электрического поля должна составить 2 В/см в течение первых 15 мин для вхождения проб в гель (30 – 40 В) и затем 3 – 4 В/см (60 – 70 В) в течение примерно 1 – 1,5 ч.
Включить напряжение. ДНК движется в электрическом поле от катода (-) к аноду (+). Напряженность электрического поля должна составить 2 В/см в течение первых 15 мин для вхождения проб в гель (30 – 40 В) и затем 3 – 4 В/см (60 – 70 В) в течение примерно 1 – 1,5 ч.


