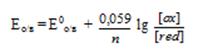Окислительно-восстановительные потенциалы и электродыРаствор, содержащий одновременно окисленную и восстановленную формы вещества, называют окислительно-восстановительной системой (о/в) системой. Инертный токопроводящий металл (например, платина или иридий), погруженный в окислительно-восстановительную систему, образует окислительно-восстановительный электрод. Например: раствор, содержащий соль Cu2+ и соль Cu+ – является окислительно-восстановительной системой. Cu2+ - окисленная форма; Cu+ -восстановленная форма. Электродная реакция Cu2++1e ↔ Cu+ Примером о/в электрода может служить платиновая пластинка, опущенная в о/в - систему, содержащую окисленную и восстановленную форму вещества. Рt | Cu2+; Cu+ Стандартный электродный о/в потенциал Е0Сu2+/Cu+ = +0,153 В Потенциал, возникающий на границе соприкосновения пластинки инертного металла с о/в - системой, называется о/в или red–ox -потенциалом. На практике определение стандартных о/в потенциалов различных систем проводят по отношению к нормальному водородному электроду при t = 25 °С и рН=0. По этим потенциалам составляют электрохимический ряд активности,который позволяет судить о возможности и направлении о/в процессов. Чем больше величина стандартного о/в потенциала, тем сильнее окислительные свойства системы. Чем меньше величина Е0о/в, тем сильнее восстановительные и слабее окислительные свойства вещества. Величину о/в потенциала рассчитывают по уравнению Нернста-Петерса
При Т = 298 К уравнение Нернста-Петерса имеет вид
Например, электродный о/в потенциал системы Cu2++1e ↔ Cu+ по уравнению Нернста- Петерса при Т = 298 К равен:
Е (Сu2+/Cu) = Е0 (Сu2+/Cu) + lg По величине стандартных о/в потенциалов можно определять направление самопроизвольного протекания реакций, а также вычислять ЭДС элементов построенных на основе этих реакций. Чем выше значение стандартного электродного потенциала Е0, тем выше окислительная способность системы, т.е. на этом электроде будет протекать процесс восстановления. На электроде с более отрицательным значением Е0, где выше восстановительная способность системы, протекает процесс окисления. Например, определим направление реакции: 2Fe3+ + 2I– ↔ 2Fe2+ + I2 Е0 (Fe3+/Fe2+) = 0,77 В – окислитель Е0 (I2/2I–) = 0,54 В – восстановитель Потенциал первой системы больше, т.е. способность притягивать электроны у Fe3+ выше, чем у I2. Следовательно, реакция протекает в прямом направлении. Определим ЭДС элемента, построенного на основе этой реакции:
Pt│Fe3+; Fe2+║I-; I2│Pt
ЭДС = 0,77 – 0,54 = 0,23 В.
Электроны перемещаются от более активного о/в электрода ( менее положительного)к менее активному о/в электроду (более положительному). Окислительно-восстановительный процесс может протекать в нужном направлении при условии, что ЭДС будет положительна.
Контрольные вопросы 1. Окислительно – восстановительные системы, их классификация. 2. Окислительно-восстановительные электроды. Роль инертного металла в них. Применение в медицине. 3. Окислительно-восстановительные потенциалы. 4. Уравнение Нернста – Петерса для простых и сложных окислительно-восстановительных систем, его анализ. 5. Направление окислительно-восстановительных процессов.
|