поглинання
довжина хвилі, нм
Рис. 8.1. Спектр поглинання гемоглобіну та оксигемоглобіну
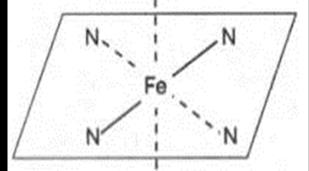
Відомо, що білки діляться на прості (при гідролізі утворюють тільки амінокислоти) та складні (при гідролізі утворюють, крім амінокислот, органічні або неорганічні сполуки). Небілкова частина складного білку називається простетичною групою. Цитохроми мають простетичну групу, у складі якої є атоми заліза (гемовий білок). Простетична група, що міститься атом заліза, називається гемом, а білки, що мають гем - гемовими (рис. 8.2). N
О2 Рис. 8.2. Будова гема
Простетична група гемоглобіну це молекула протопорферину з гемом заліза (рис.8.3, В). Атом Fe2+ утворює два ковалентні та два координаційні зв'язки з атомами азоту пірольних кілець протопорфирину (рис. 8.3, Б). Залізо Fe2+ легко віддає електрони і переходить в окиснений стан:
Fe+2 - е- ↔ Fe+3 відновлений стан окиснений стан
При віддачі електронів залізо окиснюється, при приєднання - відновлюється. Порфирин - циклічна структура, що складається з чотирьох пірольних кілець, пов'язаних між собою метановими містками (рис.8.3, А). Протопорфирин (рис.8.3, Б) має чотири метильных, два вінільних радикала та два залишки пропіонової кислоти. Цитохроми відіграють важливу роль в метаболізмі ксенобіотиків в організмі людини (метаболізують біля 60% лікарських речовин), здійснюють реакції окиснення молекулярним киснем органічних сполук і є важливим елементом системи детоксикації ксенобіотиків. Локалізовані, в основному, в мембранах, а в еукаріотів (рослини та тварини) - в мітохондріальних мембранах та ендоплазматичному ретикулумі.
Рис. 8.3. Будова молекули: А - порфирину, Б - протопорфирину і В - гемоглобіну (протопорфирин з гемом заліза) Цитохром Р450. Система цитохрому Р450 відноситься до однієї з найдревніших ферментних систем і виявлена у усіх прокаріотів і еукаріотів. Ізоформи цитохрому Р450 локалізовані в різних органах і тканинах організму. Цитохром Р450 має широку субстратну специфічність, утворює свою ізоформу для кожного субстрату. Сім¢я ізоформ цитохрому Р450 бере участь в великій кількості реакцій. Основна роль системи цитохрома Р450 в клітинах організму − метаболізм ендогенних сполук та ксенобіотиків. Його субстратами можуть бути нормальні клітинні компоненти, метаболіти внутрішньоклітинних реакцій та ксенобіотики, що не є компонентами клітин живих організмів. Це можуть бути хімічні сполуки, що надходять ззовні, лікарські засоби. Цитохром Р450 приймає участь в детоксикації цих сполук, тобто під дією цитохрому Р450 ксенобіотики перетворюються в продукти, що швидко виводяться з організму. Цитохроми класифікують за їх спектрами поглинання в області довжин хвиль між 400 і 600 нм. Індивідуальний спектр цитохрому Р450 має максимум при довжині хвилі 450 нм. Цитохром b5 є одним з компонентів системи цитохрому Р450. Цитохром b5 є гемопротеїном, має гемову групп. Фермент бере участь в разноманітних біохімічних окисно-відновних реакціях як переносник електронів, локалізований в еритроцитах та цитозолі, присутній в різних клітинах організму. Це мембранний білок, що входить до складу білків ендоплазматичних мембран. Має 93 амінокислотних залишки і одну гемову групу, що пов¢язана з білком двома гістидиновими залишками. Відомі ізоформи цитохрому b5 можна разділити на 2 групи - розчинні та мембранопов'язані. Індивідуальний спектр цитохрому b5 має два характерні поглинання: mіn при довжині хвилі 410 нм і max при довжині хвилі 425 нм. В природі відомо 25-30 різних цитохромів. Гепатоцити - клітини печінки людини і тварин. Складають від 60% до 80% маси печінки. Ці клітини беруть участь в синтезі і зберіганні білків, трансформації вуглеводів, синтезі холестерину, жовчних солей і фосфоліпідів, детоксифікації, модифікації і виведенні з організму ендогенних субстанцій. Також гепатоцити ініціюють процес утворення жовчі. Гепатоцити мають інтенсивний і високоспеціалізований клітинний метаболізмом, містять багато специфічних ферментів. Якщо йде мова про ушкодження печінки, то мається на увазі саме ушкодження гепатоцитів і синтезу ферментів, які вони містять. Багато ферментів печінки, що синтезуються в гепатоцитах, виділяються в кров'яне русло і функционирують по всьому організму. Деякі ферменти і ферментні системи гепатоцитів печінки міцно пов'язані з клітинною мембраною і мужуть визначаться тільки після руйнування клітини. Активність цитохромів, як і всіх ферментів проявляється за швидкістю каталізованої ними реакції при певній температурі, рН середовища та концентрації субстрату. Тому при визначенні активності ферментів необхідно суворо дотримуватися певних умов. Такі ж умови повинні дотримуватися і при виділенні і очищенні ферментів. Питома і молекулярна активність білків. Активність білку, що відноситься до одиниці маси білку називається питомою, а активність білку розрахована на молекулу – молекулярною. Питома активність білків виражається частіше всього в мікромолях або в наномолях субстрату перетвореного за 1 хвилину 1 мг фермента. Молекулярна активність білків виражається числом молекул субстрату, перетворених за одну хвилину однією молекулою ферменту або числом молекул субстрату, перетворених за одну хвилину одиним активним центром. Кількість речовини. Одиниця кількості речовини. Кількість речовини визначається числом структурних одиниць (атомів, молекул, іонів або інших частинок) цієї речовини. Для вимірюваний кількості речовини в хімії використовують одиницю, що носить назву моль. Моль – це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів тощо), скільки атомів містить 12 г вуглецю. 1 М це концентрація речовини, що дорівнює концентрації 1 моль/л. Кількість структурних одиниць (молекул, атомів, іонів, електронів), що містить один моль речовини, дорівнює N = 6,02·1023. Ця величина носить назву числа Авогадро. 1 г-моль це кількість г речовини, що чисельно дорівнює її молекулярній масі. Молярна маса - це маса одного моля речовини, тобто така її кількість, в якій міститься стільки ж атомів, скільки в 12 г вуглецю. По-іншому, така кількість називається числом (або постійною) Авогадро. Відповідно до неї в рівних об’ємах ідеальних газів (при однакових температурі і тиску) повинно міститися однакове число молекул. Молярну масу вимірюють у грам - моль (г-моль). Чисельно вона дорівнює молекулярній (або атомній) масі речовини. Молекулярна маса речовини дорівнює сумі атомних мас елементів, що входять до складу молекули.
Визначення активності або вмісту ферментного білку проводиться методами спектрофотометрії. Спектри поглинання білків різної природи суттєво відрізняються між собою. Для біологічних молекул характерні широкі смуги поглинання, обумовлені електронними, коливальними і обертальними рівнями. Властивість атомів і молекул поглинати світло з певною довжиною хвилі, характерною для цих білків, широко використовується для якісних і кількісних досліджень їх складу та активності. Молекулярні групи, що містяться у ферментних білках і активно поглинають світло, називаються хромофорами. При проходженні через розчин речовини світло поглинається. Згідно із законом Бугера-Ламберта-Бера. Якщо інтенсивність падаючого потоку позначити як Io, а інтенсивність світлового потоку, що пройшов через розчин білку як I, то відношення I/Io називають величиною пропускання, а логарифм цього відношення є величиною поглинання.
I А= lg T = lg ---- = e ∙ l ∙ C, Io де А - поглинання речовини, або оптична густина. Для абсолютно прозорого розчину А = 0, для абсолютно непрозорого – А ®¥. Т - пропускання зразка, тобто відношення інтенсивності світла того, що пройшло через зразок, до інтенсивності світла, що падає; I/Iо - молярна поглинальна здатність речовини; C - концентрація речовини (моль/л); l – товщина світлопоглинаючого шару (товщина кювети), см; e - молярний коефіцієнт поглинання або екстинкції білку дорівнює оптичній щільності одномолярного розчину цього білку в кюветі з товщиною поглинаючого шару 1 см. Це індивідуальна характеристика речовини, він залежить від природи речовини і поглинає світло певної довжини хвилі.
З формули видно, що за експериментально визначеною величиною поглинання при певній довжині хвилі, можна визначити концентрацію речовини якщо відомий молярний коефіцієнт поглинання ε; для цієї речовини. Білки можуть поглинати світло у видимій (400-700 нм) або ультрафіолетовій (200-400 нм) областях спектра. Більшість білків мають максимум поглинання при довжині хвилі 280 нм, що обумовлюється вмістом в них залишків триптофану та тирозину. Нуклеїнові кислоти також частково поглинають світло при довжині хвилі 280 нм. Часто білки мають характерний спектр поглинання. Для цитохрому Р450 це поглинання при 450 нм (max), для цитохрому b5 - при 409 нм (min) та при 428 нм (max), що дає змогу визначити їх вміст в білковій суміші. Визначення залежності концентрації поглинаючої речовини від величини поглинання при певній довжині хвилі проводиться за методами спектроскопії. Для реєстрації спектрів поглинання використовуються спектрофотометри. Найчастіше використовувані спектрофотометри мають діапазон вимірів по довжинах хвиль 180-1100 нм. Цей діапазон включає три області спектру: ближню ультрафіолетову область(УФ) - 180-380 нм; видиму - 380-760 нм і ближню інфрачервону(ГИК) - 760-1100 нм. Область вимірювання спектрупоглинання конкретного білку визначається виходячи з його властивостей. Основне рівняння квантової теорії випромінення та поглинання: DЕ = Е2 – Е1 = hn,
де Е1 та Е2 – енергія двох квантових рівнів, між якими здійснюється перехід; h - стала Планка, постійна величина; n - число довжин хвиль енергії, що випромінюється або поглинається. За допомогою закону Ламберта-Бера можна встановити зв¢язок між величиною поглинанням і природою білку, що поглинає. Згідно цього закону I0 DD = lg ------- = e × c × l × конц. загального білку I де: I0 – інтенсивність світового пучка, що падає на розчин білку; I - інтенсивність світового пучка, що виходить після розчину білку; DD - величина поглинання білку при певній довжині хвилі, визначається за графіком; c – концентрація білку, що зумовлює даний спектр поглинання, моль/л; e - коефіцієнт молярної екстинкції або молярний коефіцієнт поглинання – це поглинання 1 М (одномолярного) розчину даного білку; l – товщина поглинаючого шару, см. У випадку роботи на спектрофотометрі це товщина кювети, в якій знаходиться розчин (l =1 см); e - молярний коефіцієнт поглинання, (М-1٠см-1), величина приводиться в таблицях. З формули (1) витікає, що D D с = ------------------------- = А моль/г білку або мілімоль/мг білку e × l × конц.білку
де DD = I – I0 поглинання білкового розчину, вимірюється для цит. b5 та цит. Р450 по їх спектру поглинання приведеному в індивідуальному завданні; e - коефіциєнт молярної екстинкції для цит. b5 і цит. Р450 див. табл. 8.1; l = 1 см; концентрацію білку мг/мл вираховуємо за об'ємом реакційної суміші та концентрацією білку мікросомальної фракції (приведена в індивідуальному завданні). Наприклад: Vреакційної суміші = Vбуфера + Vфракції мікросом = = 7,2 мл + 0,2 мл = 7,4 мл Концентрація білку фракції мікросом = 18,4 мг/мл.
Отже, 18,4 мг білку міститься в 1 мл розчину білку, а х мг білку - в 0,2 мл цього розчину, 18,4 ∙ 0,2 звідси х = ------------ = 3,68 мг 3,68 мг білку міститься в 7,4 мл (Vреакційної суміші), а у мг білку - в 1 мл,
3,68 ∙ 1 звідси у = --------- = 0,497 мг/мл 7,4 Перевірка формули за одиницями розмірності: 1 М × см × мл мілімоль × мл мілімоль с = -------------------------------- = ---------------- = ------------------- = ------------- М-1× см-1 ×см × мгбілку/мл см × мгбілку мл × мгбілку мгбілку Таблиця 8.1 Коефіцієнт молярної екстинкції деяких цитохромів
Хід роботи Розрахунок вмісту цитохромів b5 та Р450 проводяться за формулою (1) та спектрами поглинання (рис. 8.4).
Рис. 8.4. Спектр поглинання цитохромів b5 та Р-450: - цитохром Р450 має характерний max при довжині хвилі 450 нм; - цитохрому b5 має mіn при довжині хвилі 410 нм і max при довжині хвилі 425 нм.
Визначення вмісту цитохрому b5 основано на величині поглинання (ΔD) відновленої форми (min при 410 нм та max при 425 нм): ΔD для цит b5 = поглинання при 425 нм – поглинання при 410нм Вміст цитохрому Р450 вимірюється величиною поглинання (ΔD) комплекса відновленого цитохрому з оксидом (СО) при 450 нм. ΔD для цит Р450 = поглинання при 450 нм – поглинання при 490 нм Завдання для виконання 1. Вирахувати за індивідуальним завданням поглинання (D D) для цит. Р450; 2. Вирахувати за індивідуальним завданням поглинання (D D) для цит. b5; 3. Вирахувати концентрацію білку в кюветі (поглинаючий розчин), якщо відомий об¢єм реакційної суміші та концентрація білку мікросомальної фракції; 4. Розрахувати вміст цитохромів Р450 та b5 за спектрами поглинання, якщо відомо: - концентрацію білку у поглинаючому розчині; - коефіцієнт молярної екстинкції цитохрому Р450 (табличні дані); - коефіцієнт молярної екстинкції цитохрому b5 (табличні дані). 5. Написати висновок. Контрольні запитання 1. Як одержують клітинний екстракт. 2. Біохімічні методи дослідження білків. 3. Методи генної інженерії. 4. Ферменти. Їх роль в організмі. 5. Що таке металоферменти. 6. Які метали входять до складу металоферменті. 7. Що таке залізовміщуючі білки. 8. Які ви знаєте залізовміщуючі білки. 9. Функція залізовміщуючих білків в організмі. 10. Що таке гем. 11. Будова гема. 12. Характеристика цитохромів Р450 та b5. 13. Питома і молекулярна активність білків. 14. Що таке М і г-моль. 15. Закон Бугера-Ламберта-Бера. 16. Що таке коефіцієнт молярної екстинкції. РЕКОМЕНДОВАНА ЛІТЕРАТУРА 1. Пентин, Ю.А. Основы молекулярной спектроскопии/ Ю.А.Пентин. - М.: Мир, 2008.- 398 с. 2. Шмидт, В. Оптическая спектроскопия для химиков и биологов / В. Шмидт.- М.: Техносфера, 2007. - 368 с. 3. Нельсон, Д. Основы биохимии Ленинджера. В 3 т. / Д. Нельсон, М. Кокс. - М.: Бином. Лаборатория знаний, 2012. - 694 с.
|