Скорость химических реакций. Химическая кинетика – раздел химии, изучающий скорость и механизм химических реакцийХимическая кинетика – раздел химии, изучающий скорость и механизм химических реакций. Скоростью химической реакции называют изменение количества вещества в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций). Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов. Зависимость скорости реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Для реакции nА + mВ = gАВ математическое выражение закона действия масс имеет вид v = kСАn СB m , где v – скорость химической реакции; СА и СВ – концентрации реагирующих веществ; n, m – коэффициенты в уравнении реакции; k – константа скорости реакции. Значение константы скорости не зависит от концентрации реагирующих веществ, а зависит от их природы и температуры. В случае гетерогенных реакций концентрации веществ, находящихся в твердой фазе, обычно не изменяются в ходе реакции и поэтому не включаются в уравнение закона действия масс. Например, для реакции горения углерода С (к) + О2(г) = СО2(г) закон действия масс запишется как: v = k При повышении температуры скорость химических реакций увеличивается. Согласно правилу Вант-Гоффа, при повышении температуры на 10 градусов скорость реакции увеличивается в 2-4 раза:
где v2 и v1 – скорость реакции при температурах Т2 и Т1; γ – температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 градусов.
|

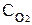

 ,
,


