Электролитическая диссоциация. Реакции ионного обменаЭлектролитическая диссоциация – это процесс распада молекул электролита на ионы под действием полярных молекул растворителя. Электролиты – это вещества, расплавы или водные растворы которых проводят электрический ток. К ним относятся растворы кислот, расплавы и растворы щелочей и солей. Неэлектролиты – это вещества, которые не проводят электрический ток. К ним относятся многие органические вещества. Электролиты, которые практически полностью диссоциируют на ионы, называются сильными; электролиты, которые частично диссоциируют на ионы, называются слабыми. Для количественной оценки полноты диссоциации введено понятие степени диссоциации. Степенью диссоциации электролита называют отношение числа молекул, распавшихся на ионы, к общему числу молекул, находящихся в растворе. Обычно степень диссоциации (α;) выражают в долях единицы или %:
где n – число частиц, подвергшихся электролитической диссоциации; n0 – общее число частиц в растворе. Сильные электролиты – почти все соли, растворимые основания (NaOH, KOH, Ba(OH)2 и др.), неорганические кислоты (H2SO4, HCl, HNO3, HBr, HI и др). Слабые электролиты – нерастворимые основания и NH4OH, неорганические кислоты (H2CO3,, H2S,, HNO2, H3PO4 и др.), органические кислоты и вода H2O. Сильные электролиты диссоциируют на ионы практически нацело (т.е. процесс диссоциации является необратимым) и одностадийно: HCl = H+ + Cl– H2SO4 = 2H+ + SO42– Слабые электролиты диссоциируют частично (т.е. процесс диссоциацииявляется обратимым) и ступенчато. Например, для многоосновных кислот на каждой стадии происходит отрыв одного иона водорода: 1. H2SO3 ⇄ H+ + HSO3- 2. HSO3- ⇄ H+ + SO32- Таким образом, число стадий многоосновных кислот определяется основностью кислоты (числом ионов водорода), а число стадий многокислотных оснований будет определяться кислотностью основания (или числом гидроксильных групп): Константа равновесия процесса электролитической диссоциации называется константой диссоциации – КД. Константа диссоциации зависит от природы электролита, природы растворителя, температуры, но не зависит от концентрации электролита. Между КД и α; существует количественная связь:
Соотношение (13) называют законом разбавления Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора. Для слабых электролитов, когда α<<1, КД = α2С. Вода является слабым электролитом, поэтому диссоциирует обратимо: H2O ⇄ H+ + OH– ∆H = +56,5кДж/моль Константа диссоциации воды: Степень диссоциации воды очень мала (это очень слабый электролит). Так как вода присутствует в большом избытке, то ее концентрация может считаться величиной постоянной и составляет КД [H2O] = [H+]∙[OH-] = 55,6∙1,8∙10-16 = 10-14 [H+]∙[OH-] = 10-14 = KW – ионное произведение воды Так как в воде концентрации катионов водорода и гидроксид-ионов равны, то: [H+] = [OH-] = Растворение в воде других веществ (кислот, оснований, солей) изменяет концентрацию ионов Н+ или ОН–, а их произведение всегда остается постоянным и равным 10-14 при Т=250С. Концентрация ионов Н+ может служить мерой кислотности или щелочности раствора. Обычно для этой цели используется водородный показатель: pH = -lg[H+]. Таким образом, водородный показатель – это десятичный логарифм концентрации ионов водорода, взятый с обратным знаком. В зависимости от концентрации ионов водорода различают три среды. В нейтральной среде [H+] = [OH-]= 10-7 моль/л, рН= – lg 10-7 = 7. Эта среда характерна как для чистой воды, так и для нейтральных растворов. В кислых растворах [H+] > 10-7моль/л, рН < 7. В кислых средах рН меняется в пределах 0 < рН < 7. Реакции ионного обмена (РИО) – это реакции между ионами, протекающие в водных растворах электролитов. Отличительная особенность обменных реакций: элементы, входящие в состав реагирующих веществ, не меняют свою степень окисления. Реакции ионного обмена являются необратимыми реакциями и протекают при условии: 1) образования малорастворимого вещества, 2) выделения газообразного вещества, 3) образования слабого электролита. При протекании РИО противоположно заряженные ионы связываются и выводятся из сферы реакции. Сущность реакций ионного обмена выражают с помощью ионных уравнений, которые, в отличие от молекулярных, показывают истинных участников реакции. При составлении ионных уравнений следует руководствоваться тем, что вещества малодиссоциирующие, малорастворимые (выпадающие в осадок) и газообразные записываются в молекулярной форме. Сильные растворимые электролиты записываются в виде ионов. Поэтому при написании ионных уравнений необходимо пользоваться таблицей растворимости солей и оснований в воде. Гидролиз – это процесс взаимодействия ионов соли с молекулами воды, приводящий к образованию малодиссоциированных соединений; является частным случаем реакций ионного обмена. Гидролизу подвергаются соли, образованные: 1) слабой кислотой и сильным основанием (NaCH3COO, Na2CO3, Na2S,); 2) слабым основанием и сильной кислотой (NH4Cl, FeCl3,, AlCl3,); 3) слабым основанием и слабой кислотой (NH4CN, NH4CH3COO). Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются: Na2SO4, BaCl2, NaCl, NaJ и т.д. Гидролиз солей увеличивает концентрации ионов Н+ или ОН–. Это приводит к смещению ионного равновесия воды и в зависимости от природы соли сообщает раствору кислую или щелочную среду (см. примеры решения задач).
|

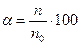 , (12)
, (12)
 (13)
(13)
 , тогда
, тогда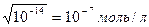 .
.


