Кислот и основанийВ растворах сильных кислот и оснований рН зависит от концентрации (активности) кислоты и основания, а активность ионов [H+] и [OH− ] может быть рассчитана по уравнениям: а (H+) = α кажCэк (кислоты); а (ОН-) = α кажCэк (основания), где а (H+) и а (ОН-) – активности ионов H+ и ОН-, α каж – кажущаяся степень диссоциации кислоты и основания. Для предельно разбавленных растворов сильных кислот и оснований α каж ≈ 1, тогда активности и молярные концентрации эквивалентов равны, т.е.: pH = –lg Cэк (кислоты); pОH = –lg Cэк (основания). В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему применим закон действующих масс. Так, при диссоциации кислоты типа НА кислотно-основное равновесие имеет вид: НА ↔ Н+ + А− Константа кислотной диссоциации В соответствии с реакцией диссоциации [H+]=[А− ]. Поскольку [HА]= Сэк (НА) − [H+], то Ка = Для расчета концентрации ионов водорода в растворе получают уравнение: [Н+] = Рассуждая аналогичным образом, можно получить выражение константы диссоциации слабого основания: Кв =
рОН = 1/2[р Кв − lg Сэк (основания)]; рОН = 14 − рОН = 14 − 1/2[р Кв − lg Сэк (основания)]. В растворах различают активную, потенциальную (резервную) и общую кислотность. Активная кислотность измеряется активностью (концентрацией) свободных ионов водорода в растворе. Потенциальная (резервная) кислотность измеряется количеством ионов водорода, связанных в молекулах кислоты. Сумма активной и резервной кислотностей составляет общую кислотность, которая определяется общей аналитической концентрацией кислоты и устанавливается титрованием. Активная кислотность определяет рН данного раствора.
Вопросы для самоконтроля 1. Дайте определение понятиям: ионное произведение воды К(Н2О), водородный показатель рН, гидроксильный показатель рОН. 2. Приведите примеры слабых электролитов (кислот, оснований, солей). 3. Напишите выражение константы диссоциации слабой одноосновной кислоты и слабого однокислотного основания. 4. Напишите формулы для вычисления рН растворов слабых одноосновных кислот и слабых однокислотных оснований. Задачи 1. К 400 мл 10%-го раствора КОН (ρ =1, 09 г/мл) добавили 800 мл воды. Вычислите рН и рОН раствора. 2. Рассчитайте рН 4%-го раствора НNО3 3. В 400 мл раствора NаОН содержится 0, 16 г NаОН. Вычислите рН раствора. 4. рН уксусной кислоты равен 3, 4. КД (СН3СООН) = 1, 86·10-5. Определите молярную концентрацию эквивалентов этой кислоты. 5. К 250 мл воды прибавили 50 мл 8%-го раствора КОН (ρ =1, 065 г/мл). Рассчитайте рН полученного раствора. 6. рН раствора КОН равен 8. Определите молярную концентрацию эквивалентов раствора. 7. К 20 мл 0, 01 н раствора NаОН прибавили 40 мл 0, 01 н раствора НСl. Вычислите рН полученного раствора. 8. Вычислите рН раствора бромноватистой кислоты с концентрацией 0, 001 н. КД (НВrO) = 2, 2·10-9. 9. Вычислите рН раствора йодноватой кислоты c концентрацией 0, 1 М. КД (НIO3) = 1, 6·10-2. 10. Вычислите рН раствора соляной кислоты, в 11. Вычислите рН 0, 6%-го раствора NаОН 12. Вычислите рН раствора уксусной кислоты, в 13. К 200 мл 10%-го раствора NаОН (ρ =1, 12 г/мл) добавили 200 мл воды. Вычислите рН и рОН раствора. 14. Вычислите рН 0, 01 М раствора муравьиной кислоты. КД (НСООН)=1, 8·10-4. 15. К 1 л воды добавили 2 мл 72%-го раствора НNО3 (ρ =1, 48 г/мл). Раствор разбавили водой до 2 л. Вычислите рН полученного раствора. 16. Определите рН раствора, в 1 л которого содержится 0, 1 г NаОН. 17. Вычислите рН 3, 12%-го раствора НСl 18. Определите рН 0, 01 н раствора NН4ОН, если КД (NН
|


 .
. .
.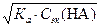 . Взяв отрицательный десятичный логарифм обеих частей этого уравнения, получают: рН = 1/2[р Ка − lg Сэк (НА)].
. Взяв отрицательный десятичный логарифм обеих частей этого уравнения, получают: рН = 1/2[р Ка − lg Сэк (НА)]. ;
; ОН) = 1, 86·10-5.
ОН) = 1, 86·10-5.


