Методические указания к лабораторным работамI семестр
«Общая и неорганическая химия» Основные классы неорганических соединений Важнейшими классами неорганических соединении являются оксиды, кислоты, гидроксиды (основания) и соли. Оксиды Оксид - химическое соединение, состоящее из какого-либо элемента и кислорода. Почти все химические элементы образуют оксиды. По химическим свойствам оксиды делятся на три группы: основные, кислотные и амфотерные. Основными оксидами называются такие оксиды, которым соответствуют основания. Например, Na2O, CaO, FeO, NiO - основные оксиды, т.к. им соответствуют основания NaOH, Ca(OH)2, Fe(OH)2, Ni(OH)2. Основные оксиды щелочных и щелочноземельных металлов при взаимодействии с водой образуют основания. Например, Na2O + H2O = 2NaOH; CaO + H2O = Ca(OH) 2. Другие основные оксиды непосредственно с водой не взаимодействуют, а соответствующие им основания получают из солей. Например, NiSO4 + 2NaOH = Ni(OH)2 + Na2 SO4. Основные оксиды образуются только металлами. Кислотными оксидами (или ангидридами кислот) называются такие оксиды, которым соответствуют кислоты. Например: CO2, P2O5, SO2, SO3 – кислотные оксиды, т.к. им соответствуют кислоты H2CO3, H 3PO4, H2SO3, H2SO4. Большинство кислотных оксидов при взаимодействии с водой образуют кислоты: SO 3 + H2O = H2SO4; CO2 + H2O = H2CO3. Некоторые кислотные оксиды с водой не взаимодействуют, однако сами они могут быть получены из соответствующей кислоты: Кислотные оксиды образуются неметаллами и некоторыми металлами, проявляющими высокую степень окисления (например, оксиду Mn2O7 отвечает марганцовая кислота HMnO 4). Амфотерными называются такие оксиды, которые в зависимости от условий проявляют основные или кислотные свойства, т. е. обладают двойственными свойствами. К ним относятся оксиды некоторых металлов: ZnO, Al2O3, Cr2O3 и др. Амфотерные оксиды непосредственно с водой не взаимодействуют, но реагируют и с кислотами, и с основаниями. Например: ZnO + 2HCl = ZnCl 2 + H2O; ZnO + 2NaOH + H2O = Na2 [Zn(OH4)]; BeO + 2HCl = BeCl 2+ H2O; BeO + 2KOH + H2O = K 2 [Be (OH4)]. Свойства оксидов удобно рассматривать, пользуясь периодической системой элементов Д.И.Менделеева. По периоду с возрастанием порядкового номера элемента ослабевают основные свойства оксидов элементов главных подгрупп (за исключением элементов I периода) Одновременно усиливаются их кислотные свойства. Например, свойства оксидов элементов III периода Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7 закономерно изменяются с ростом порядкового номера элемента от основных (Na2O, MgO) через амфотерный (Al2O3) к кислотным (SiO2, P2O5 , SO3, Cl2O7). В каждой главной подгруппе (за исключением VIII) c увеличением порядкового номера элемента возрастают основные свойства оксидов и уменьшаются кислотные свойства. Например, у оксидов элементов II группы, главной подгруппы MgO, CaO, SrO, BaO, RaO основные свойства сильнее выражены у RaO, нежели у MgO, у оксидов элементов Vгруппы главной подгруппы N2O5, P2O5, As2O5, Sb2O5 кислотные свойства сильнее выражены у N2O5, нежели у Sb2O5. Названия оксидов образуются из слова «оксид» и названия химического элемента. Если элемент образует несколько оксидов, то после названия элемента указывается степень окисления элемента (в скобках римской цифрой). Например: FeO – оксид железа (II), Fe2O3 – оксид железа (III), SO2 – оксид серы (IV), SO3 – оксид серы (VI). Оксиды могут быть получены различными способами, главными из которых являются следующие: 1. Непосредственное соединение простого вещества с кислородом: 2.Горение сложных веществ: CH4 + 2O2 t = CO2 +2H2O. 3. Разложение кислородных соединений при нагревании (карбонатов, нитратов, гидроксидов) 2Cu(NO3)2 Химические свойства оксидов определяются их отношением к кислотам и основаниям. Основные оксиды взаимодействуют с кислотами, образуя соль и воду: CaO + 2HCl = CaCl2 + 2H2O; FeO + H2SO4 = Fe SO4 + 2H2O. Кислотные оксиды взаимодействуют с основаниями, образуя также соль и воду. SO3 + 2NaOH = Na2SO4 + 2H2O; P2O5 + 6KOH = 2K3PO4 + 3H2O. Взаимодействие основных и кислотных оксидов приводит к образованию солей. CaO + CO2 t = CaCO3
|

 .
.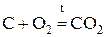 .
. ;
;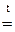 2CuO + 4NO2 + 2O2; 2Fe(OH)3
2CuO + 4NO2 + 2O2; 2Fe(OH)3 


