Химическая связь. Ионная связь
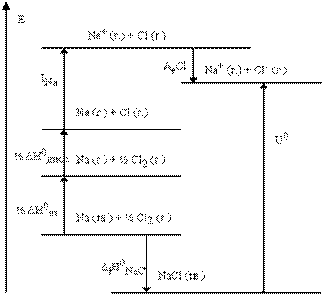
При полном смещении межъядерной электронной плотности к атому с большей электроотрицательностью длина диполя становится равной длине связи (l = d), и атомы превращаются в положительно и отрицательно заряженные ионы, между которыми действуют силы электростатического притяжения. Такую связь называют ионной. Степень полярности или ионности связи i определяется отношением l / d иварьируется от 0 до 1, что соответствует чисто ковалентной и чисто ионной связям. В остальных случаях эта величина имеет промежуточные значения. Ионная связь, в отличие от ковалентной, характеризуется: 1) ненаправленностью, так как сферическое поле вокруг ионов во всех направлениях равноценно; 2) ненасыщаемостью, поскольку при взаимодействии ионов не происходит полной компенсации их силовых полей; 3) координационными числами в ионных соединениях, которые определяются не электронной структурой атомов, а соотношением радиусов взаимодействующих ионов. Соединения с ионным типом связи не имеют молекулярного строения и представляют собой твердые вещества, образующие ионные кристаллические решетки, с высокими температурами плавления и кипения. Энергия ионной кристаллической решетки U может быть вычислена с использованием экспериментальных данных по циклу Борна - Габера. Например вычисления U NaCl, используя следующий термохимический цикл: Naк → Naг + Δ Н субл + 26 ккал Naг → Naг+ + е + I Na + 118 ккал 1/2Сl2, г → Сlг +1/2 Е связи + 29 ккал Сlг + e → Сl-г - Е сродства(Cl) - 89 ккал ___________________________ Naк + 1/2Сl2, г → Naг+ + Сl-г + 26 + 118 + 29 - 89 = 84 ккал. Вместе с тем для реакции образования NaCl к в стандартном состоянии Naк + 1/2Сl2, г → NaСlк - 98 ккал = Δ Нf. Следовательно, для процесса NaСlк → Naг+ Сl-г энергия кристаллической решетки U = - Δ Нf - Е сродства(Cl) + Δ Н субл(Na) + I Na + 1/2 Е связи(Cl2) = 182 ккал/моль. Уравнение для теоретического расчета энергии ионной кристаллической решетки было получено Борном в виде
где а — константа Маделунга, вычисляемая теоретически и учитывающая взаимодействие данного иона с другими ионами, находящимися на разных расстояниях от него; N 0 — число Авогадро 6, 02∙ 1023 моль-1, Z 1 и Z 2 - заряды ионов, e – элементарный заряд электрона 4, 8∙ 10-10 ед. CGSE, n – коэффициент отталкивания, зависящий от электронной конфигурации ионов. Для ионов с электронными конфигурациями He, Ne, Ar, Kr и Xe величина коэффициента отталкивания n= 5, 7, 9, 10, 12. Для кристаллической решетки типа NаСl, а =1, 747. Межионное расстояние r 0 заменяется суммой радиусов катиона и аниона. Свойства ионных соединений во многом определяются взаимной поляризацией входящих в их состав ионов. Поляризация иона выражается в относительном смешении ядра и окружающих его электронов внешней электронной оболочки под действием электрического поля соседнего иона; при этом валентные электроны смещаются в сторону катионов. Подобная деформация электронной оболочки ведет к понижению степени ионности связи и к превращению ее в полярную ковалентную связь.
Поляризуемость ионов (т. е. их способность деформироваться под действием внешнего электрического поля) характеризуется следующими особенностями: 1. При одинаковом абсолютном значении заряда и равных радиусах ионов поляризуемость анионов больше поляризуемости катионов. 2. Поляризуемость ионов с аналогичным электронным строением возрастает с ростом ионного радиуса (т. е. с увеличением числа электронных слоев). Так, по возрастанию поляризуемости ионы можно расположить в следующие ряды: F- < Cl- < Br- < I-; Li+ < Na+ < K+ < Rb+ < Cs+ 3. При одном и том же заряде и одинаковом радиусе ионов поляризуемость ионов с 18-электронной оболочкой (например, Сu+, Сd2+) выше, чем ионов с благородногазовой электронной структурой (Nа+, Са2+ и т. п.). Поляризующее действие иона (т. е. его способности деформировать, поляризовать другой ион) возрастает с увеличением заряда и уменьшением радиуса иона и значительно зависит от его электронной структуры. Ионы с благородногазовой электронной конфигурацией (например, Са2+ Ва2+) оказывают более слабое поляризующее действие, чем ионы с незавершенным электронным слоем (Тi2+, Fе2+, Рb2+ и т. п.). Наиболее сильное поляризующее действие (при одном и том же заряде иона) проявляют ионы с 18-электронной структурой внешнего слоя (Сu+, Ag+, Zn2+, Сd2+, Нg2+). Поскольку размеры анионов, как правило, больше размеров катионов, то анионы обладают большей поляризуемостью и меньшей поляризующей способностью, чем катионы. Поэтому при взаимодействии катиона с анионом поляризации подвергается преимущественно анион; поляризацией катиона в большинстве случаев можно пренебречь. Задачи: 1. Вычислите энергию кристаллической решетки NaF по уравнению Борна и с использованием термохимического цикла Борна – Габера. Сравнить полученные величины. 2. Вычислите по формуле Борна– Габера U (BaCl2). 3. Вычислите по циклу Борна — Габера энергию кристаллической решетки КF. 4. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки LiF. 5. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки KCl. 6. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки CaO. 7. Исходя из представлений о природе ионной связи, объясните, почему при обычных условиях ионные соединения существуют в виде ионных кристаллов, а не в виде отдельных молекул. 8. Температура плавления СаСl2 — 780 °С, СdСl2 — 560 °С; радиус иона Са2+ равен 0, 104 нм, иона Сd2+ — 0, 099 нм. Объясните различие температур плавления. 9. При переходе от СsF к СsI температура плавления кристаллов уменьшается. Объясните наблюдаемый ход изменения температур плавления. 10. Объясните неустойчивость гидроксидов меди(I) и серебра (I). 11. Объясните с позиции представлений о поляризации ионов меньшую устойчивость АuСl3 в сравнении с АuСl и РbСl4 в сравнении с РbСl2. 12. К2СО3 плавится при 890 °С без разложении, Аg2СО3 разлагается уже при 220 °С. Объяснить указанное различие. 13. ВаС12 в водных растворах диссоциирует полностью, а НgСl2 почти не диссоциирует. Объясните это различие в свойствах солей.
Задачи для самостоятельного решения: 1. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки CaF2. 2. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки CsF. 3. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки ZnO. 4. Какой из перечисленных ионов обладает большим поляризующим действием: а) Nа+; б) Са2+; в) Мg2+; г) А13+? 5. У какого из соединений — SrF2 или РbF2— температура плавления выше? 6. Какое из соединений — МgСО3 или ZnСО3 — термически более устойчиво? 7. Какой из ионов — Са2+ или Сd2+ — оказывает более сильное поляризующее действие на анионы? Занятие №12.
|

 ккал/моль,
ккал/моль,