Внутренняя энергия
При анализе работы тепловой машины Джоуль (Joule), Гельмгольц (Helmholtz) и др. установили, что теплота, подводимая к системе из окружающей среды, расходуется на совершение механической работы и на изменение некоторого свойства системы, которое получило название внутренней энергии. Внутренняя энергия (U) – это сумма всех видов энергии, которыми обладают отдельные частицы системы, за исключением кинетической и потенциальной энергии системы в целом и энергии, связанной с внешним электромагнитным и гравитационным полем. Для систем, рассматриваемых в химической термодинамике, такими видами энергии могут быть кинетическая и потенциальная энергия атомов и молекул, энергия электронов в атомах, внутриядерная энергия и другие виды энергии. На сегодняшний день неизвестны и вряд ли когда-либо будут известны все виды энергии, заключенные в веществе, поскольку материя бесконечна и бесконечны формы ее движения. Но это не создает никаких проблем для практического использования понятия «внутренняя энергия». При расчете термодинамического процесса определяющим является не абсолютное значение величины внутренней энергии системы в начальном и конечном состояниях, а только ее изменение D U. Его можно определять, приняв за точку отсчета любое состояние термодинамической системы – так называемое стандартное состояние. В химических процессах изменяются только две составляющие внутренней энергии: 1) химическая – энергия химических связей, включая энергию межмолекулярного взаимодействия. Изменение химической энергии происходит при протекании химической реакции в результате разрыва и образования химических связей в молекулах исходных веществ и продуктов реакции; 2) тепловая – кинетическая энергия движения атомов и молекул. Изменение тепловой энергии определяется изменением температуры системы как параметра кинетической энергии атомов и молекул. Внутренняя энергия является функцией состояния системы, т.е. ее изменение в каком-либо процессе зависит только от начального и конечного состояний и не зависит от пути перехода. Независимость изменения какого-нибудь свойства системы (X) от пути протекания процесса означает, что бесконечно малое приращение является полным дифференциалом (dX). Тогда элементарное количество внутренней энергии (бесконечно малое изменение) является полным дифференциалом (dU): Аналогичным свойством обладают и все остальные функции состояния системы. Величина D U (dU) считается положительной, если внутренняя энергия системы в ходе процесса увеличивается, и, соответственно, отрицательной, если уменьшается. Теплота (Q) и работа (W) в общем случае не являются функциями состояния, поскольку их изменение при переходе системы из одного состояния равновесия в другое зависит от пути протекания процесса. Соответственно элементарное количество (бесконечно малые изменения) теплоты (d Q) и работы (d W) в общем случае не являются полными дифференциалами. В равновесных процессах теплота и работа приобретают свойства функций состояния и их бесконечно малые изменения – свойства полных дифференциалов. Единицей измерения внутренней энергии является [Дж], [кДж]. Внутренняя энергия термодинамической системы зависит от природы вещества, его количества (экстенсивная величина) и параметров состояния системы. Поэтому часто ее относят к одному молю (или килограмму) вещества, измеряя в [кДж/моль], [кДж/кг]. В литературе может встречаться внесистемная единица тепловой энергии – термохимическая калория (калтх): 1 калтх = 4, 184 Дж. Величину внутренней энергии системы, находящейся в состоянии равновесия, характеризует температура, поскольку она является параметром средней кинетической энергии молекул и атомов. Более высокой температурой обладают тела, у которых средняя кинетическая энергия молекул выше. Для идеального газа внутренняя энергия 1 моля газа зависит только от температуры. Температура системы измеряется термометрами, действие которых основано на зависимости какого-либо физического свойства тела (объем, электрическое сопротивление и т.п.) от температуры с учетом принципа транзитивности теплового равновесия: если каждая из систем А и В находится в тепловом равновесии с системой С, то справедливо утверждение о тепловом равновесии А и В друг с другом. Все системы, находящиеся в тепловом равновесии друг с другом, будут обладать общим свойством – их температура будет одной и той же. В термодинамике пользуются термодинамической шкалой температур. Абсолютная температура тела Т (температура по термодинамической шкале) всегда положительна. В системе СИ единицей измерения температуры является градус Кельвина (К).
|

 . Если система совершает круговой процесс, то полное изменение внутренней энергии равно нулю:
. Если система совершает круговой процесс, то полное изменение внутренней энергии равно нулю: 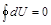 .
.


