Лекция 12. Химическое равновесие1. Обратимые и необратимые процессы 2. Константа равновесия. 3. Смещение химического равновесия. Принцип Ле—Шателье и его значение в химии. Влияние температуры, давления и концентрации реагентов на равновесие. 1. Обратимые и необратимые процессы Все химические реакции делятся на необратимые и обратимые. Необратимые химические реакции – это реакции, которые протекают в одном направлении (®) и протекают до конца, то есть до полного израсходования одного из исходных реагирующих веществ. Пример: Zn + 2HCl ® ZnCl2 + H2 Эта реакция протекает или до полного израсходования цинка (Zn), или до полного израсходования соляной кислоты (HCl).
Признаки необратимости химической реакции: 1) Образование нерастворимого осадка: AgNO3 + KCl ® AgCl¯ + KNO3; 2) Выделение газа: Cu + 4HNO3 ® Cu(NO3)2 + 2NO2 + 2H2O; 3) Образование слабого электролита (H2O и др.): KOH + HCl ® KCl + H2O; 4) Образование прочных комплексов: AgNO3 + 2NH3 ® [Ag(NH3)2]NO3; 5) Выделение большого количества тепла: 2Mg + O2 ® 2MgO + Q (где Q – очень большое количество тепла). Рассмотрим гомогенную обратимую реакцию:
На рисунке показано изменение скорости прямой реакции и обратной реакции с течением времени обратимой реакции.
В начальный момент времени при смешении в сосуде исходных веществ (H2 и I2) скорость прямой реакции определяется начальными концентрациями этих веществ и будет большой, а скорость обратной реакции (υ обр.) равна нулю, так как концентрация продукта реакции HI в начальный момент времени равна нулю. По мере протекания прямой реакции исходные вещества H2 и I2 расходуются и поэтому их концентрации уменьшаются, в результате этого уменьшается и скорость прямой реакции (υ пр.). По мере протекания прямой реакции в сосуде образуется продукт реакции HI, концентрация которого с течением времени увеличивается, поэтому и скорость обратной реакции (υ обр.) тоже увеличивается. Когда скорости прямой и обратной реакций становятся равными (в момент времени tравн.), наступает (устанавливается) химическое равновесие между водородом Н2, йодом I2 и йодоводородом HI, то есть число образуемых и распавшихся молекул HI в единицу времени становятся одинаковыми, поэтому концентрации Н2, I2 и HI с течением времени не изменяются, то есть постоянны во времени. По закону действующих масс, скорости прямой и обратной реакций выражаются следующим образом:
При наступлении химического равновесия υ пр. = υ обр., откуда получаем
Так как константы скорости kпр и kобр при данной температуре постоянны, то и их отношение kпр/kобр тоже будет постоянной величиной и называется константой химического равновесия данной реакции (обозначается большой буквой К). Таким образом, Для гомогенной обратимой реакции в общем виде:
константа равновесия будет равна:
Таким образом, константа химического равновесия обратимой реакции равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ (при этом концентрации веществ берутся в степенях, равных коэффициентам в уравнении обратимой реакции). Константа равновесия (К) характеризует степень протекания прямой и обратной реакций, а также выход продуктов реакции, и показывает, куда смещено химическое равновесие (влево или вправо). Если К намного больше единицы (например, 103), то равновесие смещено вправо (®) и выход продуктов реакции (веществ D и E) будет большим. И, наоборот, если константа равновесия намного меньше единицы (например, 10-3), то равновесие смещено влево в сторону исходных веществ (), поэтому выход продуктов реакции будет мал. Константа равновесия (К) зависит: 1) от природы реагирующих веществ; 2) от температуры. Константа равновесия (К) не зависит: 1) от концентрации веществ; 2) от присутствия катализатора. Константы равновесия можно выражать через концентрации (обозначается Кс), через давления (обозначается Кр) и через активности (обозначается Ка). Если обратимая реакция протекает в растворе, то константу равновесия этой реакции выражаем через равновесные концентрации веществ, то есть
Если протекает обратимая реакция:
причем все вещества (A, B, D и E) находятся в газообразном состоянии, то константу равновесия можно выразить через парциальные давления газов:
где рD, pE, pA и pB – равновесные парциальные давления газообразных веществ D, E, A и B соответственно. Для неидеальных газов (когда парциальные давления газов велики) и растворов высоких концентраций (когда концентрации ² с² веществ большие) константу равновесия обратимых реакций выражают через активные концентрации веществ:
где а – активность или активная концентрация вещества, которая равна: а = f× c, где с – истинная концентрация вещества, f – коэффициент активности.
то константа равновесия будет в этом случае равна:
Концентрация твердого углерода С(тв) будет практически постоянной величиной и поэтому не входит в выражение константы равновесия. Примеры:
По численному значению константы равновесия реакции можно сказать, куда сдвинуто равновесие обратимой реакции, то есть указать преобладающее (преимущественное) направление реакции (в прямом или обратном направлениях). О направлении реакции можно сказать и по изменению энергии Гиббса DG°. Поэтому DG° и константа равновесия связаны между собой соотношением: DG° = -RTlnKр, где DG° - стандартное изменение энергии Гиббса реакции; Т – абсолютная температура в градусах Кельвина; R – газовая постоянная (8, 314 Дж/моль× К). Из уравнения следует, что если DG< 0 (то есть имеет отрицательное значение), то Кр> 1 и это означает, что реакция протекает преимущественно в прямом направлении (®). Если же DG> 0, то Кр< 1 и в этом случае реакция преимущественно протекает в обратном направлении ().
2. Смещение химического равновесия. Принцип Ле-Шателье Состояние химического равновесия при данных неизменных внешних условиях сохраняется длительное время. При изменении внешних условий (изменение температуры, давления или концентрации реагирующих веществ) состояние химического равновесия нарушается и происходит смещение химического равновесия или вправо (®), то есть в сторону прямой реакции; или влево (), то есть в сторону исходных веществ. Смещение химического равновесия при изменении внешних условий подчиняется принципу Ле-Шателье, который гласит: Если изменить внешние условия (изменить температуру, давление или концентрации веществ, то химическое равновесие обратимой реакции смещается в том направлении, чтобы уменьшить внешнее воздействие.
2) при повышении давления равновесие обратимой реакции смещается в сторону уменьшения числа молей газообразных веществ, а при уменьшении давления - в сторону увеличения числа молей газообразных веществ. Например, при повышении давления равновесие обратимой реакции:
|


 Обратимые химические реакции – это реакции, которые одновременно протекают и в прямом, и в обратном направлениях (). Обратимые реакции протекают не до конца и ни одно из реагирующих веществ не расходуется полностью. Обратимая реакция заканчивается установлением химического равновесия.
Обратимые химические реакции – это реакции, которые одновременно протекают и в прямом, и в обратном направлениях (). Обратимые реакции протекают не до конца и ни одно из реагирующих веществ не расходуется полностью. Обратимая реакция заканчивается установлением химического равновесия. а) N2 + 3H2 2NH3 (синтез аммиака)
а) N2 + 3H2 2NH3 (синтез аммиака) б) CH3COOH H+ + CH3COO- (ионизация кислоты)
б) CH3COOH H+ + CH3COO- (ионизация кислоты) в) KCN + HOH KOH + HCN (гидролиз соли)
в) KCN + HOH KOH + HCN (гидролиз соли) H2(г) + I2(г) 2HI(г)
H2(г) + I2(г) 2HI(г)


 или
или

 аА + bВ dD + еЕ
аА + bВ dD + еЕ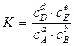 или
или - закон химического равновесия или закон действующих масс для обратимой реакции.
- закон химического равновесия или закон действующих масс для обратимой реакции. (см. выше)
(см. выше) аА(г) + bВ(г) dD(г) + еЕ(г),
аА(г) + bВ(г) dD(г) + еЕ(г),
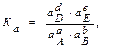
 СО2(г) + С(тв) 2СО(г),
СО2(г) + С(тв) 2СО(г),
 3H2(г) + N2(г) 2NH3(г)
3H2(г) + N2(г) 2NH3(г) 

 2SO2(г) + O2(г) 2SO3(г)
2SO2(г) + O2(г) 2SO3(г) 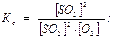

 Fe2O3(тв) + 3CO(г) 3CO2(г) + 2Fe(тв)
Fe2O3(тв) + 3CO(г) 3CO2(г) + 2Fe(тв) 
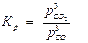
 1) при повышении температуры (нагревании) равновесие обратимой реакции смещается в сторону эндотермической реакции; при понижении температуры (охлаждении) равновесие обратимой реакции смещается в сторону экзотермической реакции. Например, при нагревании равновесие обратимой реакции 3H2 + N2 2NH3 + Q смещается влево (), а при охлаждении – вправо (®).
1) при повышении температуры (нагревании) равновесие обратимой реакции смещается в сторону эндотермической реакции; при понижении температуры (охлаждении) равновесие обратимой реакции смещается в сторону экзотермической реакции. Например, при нагревании равновесие обратимой реакции 3H2 + N2 2NH3 + Q смещается влево (), а при охлаждении – вправо (®). 3H2 (г) +N2(г) 2NH3(г)
3H2 (г) +N2(г) 2NH3(г)


