Вопрос 1.Этиленовые углеводороды. Их строение , свойства , получение и применениеОтвет. Этиленовые углеводороды, или алкены, или олефины, - органические вещества с общей формулой Cn H2n, в молекулах которых содержится одна двойная связь между атомами углерода. Представитель алкенов- этилен C2H4. Графическая формула: СH2=CH2.
Номенклатура 1. Выбирают главную цепь- цепь, содержащую двойную связь. 2. Алкен называют, производя его название от названия алкана, соответствующего ему по числу атомов углерода, и изменяя окончание – ан алкана на – ен. 3. Нумеруют главную цепь с того конца, к которому ближе расположена двойная связь. 4. Цифрой указывают номер атома углерода, находящегося при двойной связи(наименьший из двух номеров, для пропена -1 два номера при двойной связи – это 1 и 2). 1 2 3 СH2=CH-CH3. пропен-1 Изомерия 1. Структурная изомерия: а) углеродного скелета (начиная с бутена C4 и более); б) положение двойной связи или функциональных групп. 2. Пространственная изомерия.
Физические свойства Алкены C2-C4- газы, C5-C18- жидкости, C19 и более- твёрдые. Имеют низкие температуры кипения и плавления, в воде плохо растворимы, диэлектрики. Плотность меньше 1г/см3. Чем больше молекулярная масса алкен, тем выше его температура кипения.
Химические свойства Активны из-за наличия непрочной 1. Окисление: а) горение: С2H4+3O2=2CO2↑ +2H2O+Q;
б) окисление водным раствором KMnO4: 3СH2=CH2+2KMnO4+4H2O=3CH2OH-CH2OH+2MnO2↓ +2KOH;
в) окисление органической надкислотой (образование эпоксидов): 2СH2=CH2+O2
O эпоксид 2. Присоединение: а) водорода: CH3-CH=CH2+H2 пропан б) галогена: CH3-CH=CH2+Br2=CH3-CHBr-CH2Br; 1, 2-дибромпропан в) галогеноводорода (по правилу Марковникова): CH2=CH2+HBr=CH3-CH2Br; бромэтан г) воды: CH2=CH2+H2O этиловый спирт д) кислот: CH3-CH=CH2+H2CO4 пропилсерная кислота 3. Полимеризация: n(CH2=CH2)
Получение 1. Дегидрация спиртов (по правилу Зайцева): C2H5OH
Правило Зайцева: при дегидратации спиртов водород отщепляется от наименее гидрогенизированного атома углерода. 2. Из галогенпроизводных алканов:
а) CH3-CH2-Cl+KOH=CH2=CH2↑ +KCl+H2O; спиртовой раствор
б) СН2Br-CH2Br+Zn=CH2=CH2↑ +ZnBr2. 3. Дегидрирование алканов: CH3-CH3 4. Из газов крекинга нефти C4H10 алкен
5. Крекинг жидких нефтепродуктов: C16H34 алкен C8H16 алкен
Применение 1. Как основные исходные реагенты при синтезе многих органических соединений. 2. В производстве синтетических каучуков. 3. В производстве пластмасс (полиэтилен), полимеров и эластомеров. 4. Как присадки к маслам и герметики. 5. В производстве антифризов.
|

 - связи(двойная связь алкена состоит из
- связи(двойная связь алкена состоит из  - связи и
- связи и 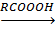 2CH2-CH3.
2CH2-CH3. CH3-CH2-CH3;
CH3-CH2-CH3;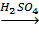 CH3-CH2-OH;
CH3-CH2-OH; CH3-CH(HSO4)-CH3.
CH3-CH(HSO4)-CH3. (-CH2 –CH2 -)n.
(-CH2 –CH2 -)n. CH2=CH2↑ +H2O.
CH2=CH2↑ +H2O.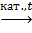 CH2=CH2↑ +H2.
CH2=CH2↑ +H2.


