Примеры решения типовых задач. Пример 1. Рассчитайте титр (г/мл), молярную (моль/л) и молярную концентрацию эквивалентов (моль экв/л) 17,5%-ного раствора серной кислотыПример 1. Рассчитайте титр (г/мл), молярную (моль/л) и молярную концентрацию эквивалентов (моль экв/л) 17,5%-ного раствора серной кислоты, плотность которого r=1,12 г/см3. Решение. 1. Определяем весовое количество серной кислоты, содержащееся в 1 л 17,5 %-ного раствора а) находим массу 1 литра (1000 мл) раствора:
б) рассчитываем весовое количество серной кислоты, содержащееся в 1120 г раствора: в 100 г раствора содержится 17,5 г H2SO4; в 1120 г раствора – х г H2SO4,
2. Определяем титр раствора; для этого необходимо весовое количество кислоты, содержащееся в известном объеме раствора, разделить на объем раствора, выраженный в миллилитрах:
3. Рассчитываем молярную концентрацию раствора; для этого необходимо весовое количество кислоты, содержащееся в 1 л раствора, разделить на молярную массу (M H2SO4), 98 г/моль:
4. Находим молярную концентрацию эквивалентов раствора H2SO4; для этого необходимо весовое количество кислоты, содержащееся в 1 л раствора (196 г), разделить на эквивалентную массу (Э H2SO4). Эквивалентная масса H2SO4 равна ее молярной массе, деленной на количество атомов водорода:
Следовательно: Молярную концентрацию эквивалентов также можно рассчитать, используя титр (Т) и эквивалентную массу (Э):
Ответ: Т =0,196 г/мл; [H2SO4]=2 моль/л; C эк=4 моль экв/л. Пример 2. Рассчитайте, сколько миллилитров 96%-ного раствора H2SO4 (r=1,84 г/см3) потребуется для приготовления 1л ее раствора с молярной концентрацией, равной 0,5 моль/л. Решение. 1. Рассчитываем весовое количество H2SO4, необходимое для приготовления 1 л раствора с молярной концентрацией, равной 0,5 моль/л (молярная масса серной кислоты равна 98 г/моль): в 1000 мл 0,5 молярного раствора содержится 98∙0,5=49 г Н2SO4. 2. Определяем весовое количество исходного (96%) раствора, содержащего 49 г Н2SO4: в 100 г раствора содержится 96 г H2SO4, в х г раствора – 49 г Н2SO4.
3. Находим необходимый объем исходного раствора, разделив весовое количество раствора на его плотность (r):
Ответ: для приготовления 1 л раствора серной кислоты с молярной концентрацией 0,5 моль/л необходимо 27,74 мл 96%-го раствора Н2SO4. Пример 3. Рассчитайте, сколько граммов этилового спирта (С2Н5ОН) и воды необходимо взять для приготовления 1000 граммов раствора, незамерзающего до –30оС? Криоскопическая константа воды K к равна 1,86кг Решение. 1. Используя следствие из закона Рауля
находим отношение
Молярная масса С2Н5ОН равна 46 г/моль. Учитывая, что
определяем количество этилового спирта, исходя из соотношения Количество воды, необходимое для приготовления раствора равно: g =1000–425,3=574,7 г. Ответ: m =425,5 г, g =574,5 г.
|

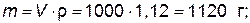
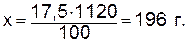
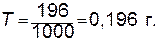







 К
К 

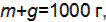
 m =425,3 г.
m =425,3 г.


