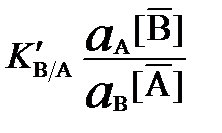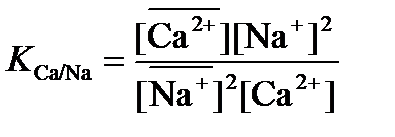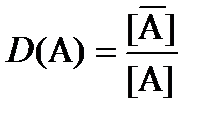Подвижные фазыВ качестве подвижных фаз в ионной хроматографии чаще всего используют водные растворы, поскольку вода обладает прекрасными растворяющими и ионизирующими свойствами. На элюирующую силу подвижной фазы основное влияние оказывают рН, ионная сила и природа буферного раствора. Значение рН выбирают в зависимости от характера матрицы ионообменника и характера ионогенных групп разделяемых ионов. Так, с сильнокислотными ионитами можно работать в интервале значений рН 1 – 14, в то время как со слабокислотными – только в интервале рН 5 – 14. Причина этоог заключается в том, что при низких значениях рН катионообменные группы слабокислотных ионообменников слишком сильно удерживают протоны для протекания ионообменной реакции. Помимо этого (в отличие от ионообменных групп сильнокислотных ионитов) они не способны полностью принимать катионы слабых оснований. Такое поведение, по сути, аналогично незавершенности реакции между слабой кислотой и слабым основанием. Аналогичные выводы справедливы и для анионообменников: сильноосновные иониты пригодны для работы в диапазоне рН от 0 до 12, в то время как слабоосновные – только при рН от 0 до 9. Для того чтобы аналиты разделялись, они должны находиться в виде ионов. Степень ионизации аналитов существенно зависит от рН. Разделение слабых кислот проводят при рН = p Ka + 1.5, а слабых оснований при рН = p K ВН+ – 1.5. При разделении амфолитов, например аминокислот, используют значение рН = p I ± 1.5 (в зависимости от выбранного ионообменника). На рисунке 9 показан пример ионообменного разделения двух аминокислот – глутаминовой кислоты и гистидина с использованием сильнокислотного ионообменника.
Рис. 9 Разделение двух аминокислот методом ионообменной хроматографии с использованием сильнокислотного катионообменника (ионы Na+, участвующие в ионном обмене, не показаны) Увеличение ионной силы подвижной фазы (применение более концентрированных растворов элюентов), как правило, приводит к увеличению элюирующей способности и как следствие к уменьшению сорбции ионов. Ионообменное равновесие Процесс обмена иона А, связанного с матрицей ионообенника (R), на ион В, находящийся в растворе, можно представить в виде равновесия: Термодинамическая константа данного равновесия характеризует способность иона В обмениваться на ион А и имеет вид:
Поскольку не существует независимых способов определения коэффициентов активности в фазе ионообменника, то на практике для описания ионообменного равновесия вместо термодинамической константы используют аналогичную концентрационную константу, называемую коэффициентом селективности (K B/A), или смешанную константу, называемую исправленным коэффициентом селективности (
При обмене ионов разного заряда стехиометрические коэффициенты в уравнении ионного обмена не равны 1, поэтому активности (концентрации) входят в выражения констант в степенях, равных соответствующим стехиометрическим коэффициентам. Например, для ионообменного равновесия:
Величина коэффициента селективности, а, следовательно, и сорбируемость ионов, зависит от размера и заряда иона, химической структуры ионообменника и условий проведения эксперимента. Так, при низких концентрациях раствора на сильнокислотных ионообменниках сорбция ионов с одинаковым зарядом увеличивается с увеличением их размера: Li+ < Na+ < K+ < Rb+ < Cs+ Для анионов аналогичный ряд на сильноосновном ионообменнике выглядит следующим образом: F- < OH- < Cl- < Br- < NO3- < I- < SCN- < ClO4- Для ионов с разными зарядами сорбируемость увеличивается в ряду: Li+ < Сa2+ < Al3+ < Th4+ Данные ряды справедливы для ионообменников с небольшим содержанием ДВБ и могут нарушаться при его увеличении. Для описания ионообменного равновесия используют также коэффициент распределения, который равен отношению равновесной концентрации иона в сорбенте к его равновесной концентрации в растворе:
|



 ):
): и
и