Кафедра химии, физики и биологииЗанятие № 11 по Химии. Руководство для студентов.
Тема: Гетерогенные равновесия и процессы. Условия образования и растворения осадков в растворах малорастворимых соединений. Значение темы: Произведение растворимости – одно из важнейших понятий, которые количественно характеризуют состояние равновесия в гетерогенных системах, характеризуют процессы, протекающие с образованием труднорастворимых соединений (осадков). Подобные равновесия имеют место в процессах жизнедеятельности, например, образование нерастворимых соединений (камней) приводит к возникновению желчекаменной или почечнокаменной болезни. Лечение их может быть эффективным с привлечением теории гетерогенных равновесий.
Цель занятия: 1. Сформировать знания о количественных закономерностях гетерогенного равновесия. 2. Выработать умения и навыки в применении произведения растворимости для управления процессами, протекающими с образованием труднорастворимых соединений. Содержание темы: Растворимость и произведение растворимости. Условия образования осадка при сливании растворов. Расчет растворимости малорастворимых электролитов в воде и растворах, содержащих другие электролиты.
Растворимость труднорастворимых соединений определяется концентрацией насыщенного при данной температуре его раствора, находящегося в равновесии с осадком. Насыщенный раствор содержит максимально возможное при данных условиях количество растворенного вещества. Количественно растворимость веществ выражается молярной концентрацией их насыщенных растворов (S [моль/л]). В насыщенных растворах
Ненасыщенный раствор – устойчивая неравновесная система, в которой концентрация вещества меньше, чем в насыщенном растворе, и, следовательно,
Возможно растворение дополнительного количества вещества вплоть до насыщения. Пересыщенный раствор – неустойчивая псевдоравновесная система, в которой концентрация вещества больше, чем в насыщенном растворе и поэтому
Пересыщенные растворы являются гомогенными системами, но при определенных условиях самопроизвольно выделяют растворенное вещество, превращаясь в гетерогенные системы (насыщенный раствор с осадком). Количественно равновесие в насыщенных растворах труднорастворимых соединений характеризуется величиной константы растворимости, которая называется произведением растворимости ПР. Для равновесия BaSO4 (тв)
произведение растворимости малорастворимого соединения определяется произведением равновесных молярных концентраций его ионов в насыщенном над осадком растворе, взятых в степенях, равных их стехиометрическим коэффициентам, и при постоянной температуре произведение растворимости является величиной постоянной. В более строгих расчетах заменяется произведением активности. Для большинства малорастворимых соединений значение ПР приведены в справочниках. В общем случае для малорастворимого электролита АхВу: АхВу(тв) ↔ хАy+(р) + уВх-(р) насыщенный раствор: ненасыщенный раствор: пересыщенный раствор: Произведение растворимости ПР - константа, пользоваться которой приходится при решении многих практических задач: 1) Выбор осадителя для отделения того или иного иона – осадитель подбирают таким образом, чтобы ПР осаждаемого соединения было наименьшим (т.е. осаждаемое вещество имело наименьшую растворимость). 2) Образование осадка – осадок труднорастворимого соединения при смешивании растворов двух электролитов может образоваться только в том случае, когда произведение реальных концентраций ионов в растворе («ионное произведение» ПИ) превысит величину произведения растворимости: ПИ > ПР – условие образования осадка (пересыщенный раствор). 3) Растворение осадка. Чтобы растворить осадок, нужно создать условие, чтобы раствор над осадком стал ненасыщенным (ПИ < ПР): - связывая хотя бы один из ионов, находящиеся в равновесии с осадком, или в комплексное соединение, или другое малодиссоциирующее соединение, или, путем изменения степени окисления одного (обоих) из ионов, или другим путем. 4) Вычислять произведение растворимости осадков по заданной их растворимости. 5) Сравнивать растворимость осадков в чистой воде и в присутствии электролитов, содержащих одноименный с осадком ион. 6) Находить объем растворителя (Н2О), в котором полностью растворится заданное количество малорастворимого соединения. Растворимость малорастворимого электролита АхВу (S [моль/л]), т.е., молярная концентрация ею насыщенного раствора, может быть вычислена по уравнению:
|

 раств =
раств = 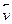 осажд
осажд раств <
раств <  Ba(p)2+ + SO4(p)2-
Ba(p)2+ + SO4(p)2- константа растворимости выражается:
константа растворимости выражается: 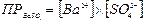 -
-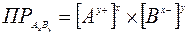 .
.
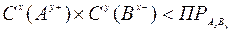 - условие растворения осадка
- условие растворения осадка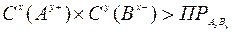 - условие образования осадка.
- условие образования осадка.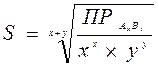 .
.


