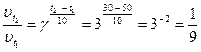Методы управления скоростью химических процессов
Влияние концентрации реагирующих веществ Необходимым условием осуществления химического превращения является сближение взаимодействующих частиц, которое в химической кинетике называется столкновением участников реакции. Таких столкновений будет тем больше, чем больше концентрация веществ.
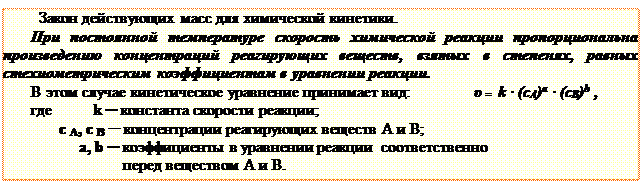
Данное уравнение называется кинетическим уравнением химической реакции. Физический смысл константы скорости в том, что она соответствует скорости той реакции, когда произведение концентраций реагирующих веществ равно единице, поэтому константа скорости реакции зависит от природы реагирующих веществ и температуры, но не зависит от концентрации. Порядок реакции равен сумме порядков реакции по отдельным реагентам и определяется экспериментально. Если допустить, что реакция протекает в одну стадию и уравнение реакции отражает её механизм, то порядок реакции будет равен сумме стехиометрических коэффициентов, и кинетическое уравнение будет называться законом действующих масс для химической кинетики.
Пример 1.11. Как изменится скорость сгорания метана СН4 (г) + 2 О2 (г) → СО2 (г) + 2 Н2О (г), если концентрацию кислорода увеличить в три раза? Решение. Кинетическое уравнение реакции, выражающее закон действующих масс, имеет вид: υ = k ∙ с (СН4) ∙ с2 (O2). При увеличении концентрации кислорода в три раза кинетическое уравнение примет вид: υ´ = k ∙ с (СН4)∙ (3 с (O2)) 2, или υ´ = k ∙ с (СН4)∙ 9 с2 (O2), тогда отношение: (υ´): (υ) = 9. Таким образом, скорость химической реакции увеличится в 9 раз. Кинетическое уравнение реакций с участием газообразных веществ может быть выражено не через концентрации, а через парциальные давления (р): υ = k ∙р (СН4)∙ р2 (O2).
В кинетические уравнения гетерогенныхпроцессов включаются концентрации только жидких и газообразных веществ, т.к. поверхностные концентрации твёрдых компонентов (сs) приняты равными единице. Например, для процесса растворения оксида меди в серной кислоте: H2SO4 (раств.) + CuO (кристалл.) → CuSO4 (раств.) + H2O(жидк.) кинетическое уравнениеимеет вид: υ = k' ∙[сs (CuO) · c (H2SO4)], υ = k ∙[с (H2SO4)]. Влияние природы реагирующих веществ и температуры С повышением температуры скорость химических реакций увеличивается.
Ход одностадийной необратимой реакции можно представить схемой (рис. 1.5).
Рис. 1.5 ─ Схема протекания реакции через активированный комплекс С повышением температуры повышается частота столкновения частиц и, казалось бы, вследствие этого должна расти скорость реакции. Однако не в этом основная причина увеличения скорости реакции. Всё дело в том, что число столкновений при любой температуре достаточно велико, и если бы каждое столкновение приводило к химическому взаимодействию, то реакции протекали бы мгновенно. Реагируют только активные (реакционноспособные) частицы, встретившиеся в пространстве благоприятным для реакции образом. Реакционная способность активных частиц может объясняться их повышенной кинетической энергией по сравнению с остальными частицами, их возбуждённым состоянием, неустойчивым расположением атомов в молекуле. Кинетическая энергия частицы должна быть достаточна для ослабления или разрыва химических связей. Энергия активации может рассматриваться как минимальный запас энергии частиц в момент столкновения, необходимый для протекания химической реакции. При этом энергии затрачивается меньше, чем было бы необходимо для полного разрыва химических связей у исходных веществ, потому что идёт компенсация энергии за счёт образования новых химических связей у продуктов реакции.
Рис. 1.6 ─ Энергетическая диаграмма реакции
Энергия активации зависит от природы взаимодействующих частиц (обычно 40 ÷ 120 кДж/моль) и мало изменяется с температурой, однако доля частиц, способных преодолеть барьер, т.е. стать активными, увеличивается с увеличением температуры (рис. 1.7). Вследствие этого увеличение температуры приводит к увеличению скорости реакции.
Рис. 1.7 ─ Схема распределения молекул по энергиям при двух температурах Присутствие катализатора Нередки случаи, когда реакция принципиально осуществима (ΔrG < 0), но в данных условиях протекает с ничтожно малой скоростью. Это зачастую связано с высокой энергией активации, причём, повышение температуры не даёт нужного эффекта. Поскольку энергия активации зависит от природы веществ, то несколько изменив их, можно увеличить скорость реакции.
Рис. 1.8 ─ Энергетическая диаграмма некаталитической (1) и каталитической (2) реакции Пример 1.17. Температурный коэффициент реакции равен 3. При охлаждении системы от 500 С до300 скорость химической реакции …
Пример 1.18. Образец СаСО3 растворяется в соляной кислоте при 20 0С в течение 6 минут, при 40 0С – за 40 секунд. Температурный коэффициент реакции равен … 6 минут составляет 360 секунд. Температура увеличилась на 20 0С, скорость увеличилась в (360: 40) = 9 раз. При изменении температуры на 10 0С скорость увеличится в три раза.
|





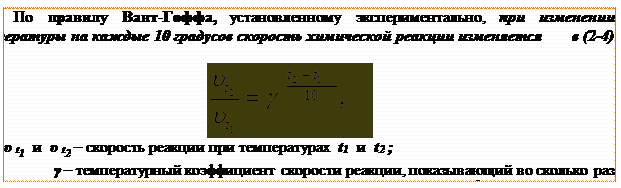





 В присутствии катализатора реакция проходит через другие промежуточные стадии с образованием иных переходных комплексов, где энергия активации меньше (рис. 1.8).
В присутствии катализатора реакция проходит через другие промежуточные стадии с образованием иных переходных комплексов, где энергия активации меньше (рис. 1.8).