Твердые тела. Аморфные и кристаллические твердые тела
В твердых телах, как уже указывалось (см. гл. 1), энергия взаимодействия между атомами (молекулами) велика по сравнению с энергиями взаимодействия в жидкостях и газах. Силы взаимодействия в твердом теле позволяют сохранять форму тела даже в условиях действия сил тяжести (в условиях Земли), а не только объем, как у жидкостей. В кристаллических твердых телах порядок расположения атомов (молекул) сохраняется на макроскопических расстояниях, т. е. расстояниях, гораздо бóльших, чем межатомные. В аморфных твердых телах порядок расположения есть только у ближайших друг к другу молекул. По существу аморфные тела ближе к жидкостям (см. гл. 1), но их вязкость столь велика, что характерное время растекания τ ~ η очень велико. Действительно, растекание, например, под действием силы тяжестиm 0 g, где m 0 = M / NAмасса молекулы, определяется силой вязкого трения (силой Стокса)
где σ — эффективное сечение молекул аморфного тела. Сохранение порядка расположения атомов (молекул, ионов) в кристаллах на больших расстояниях означает, что кристаллические тела не меняются при перемещении всех атомов в некоторое другое положение. Такое свойство сохранения порядка расположения при изменении положения называется симметрией. В кристаллическом твердом теле симметрия заключается в том, что при сдвиге в некоторых направлениях на фиксированные расстояния кристаллическое твердое тело остается тем же самым. Величина сдвига — расстояние, при котором кристаллическое тело не меняется, зависит от направления, поэтому от направления зависят и свойства кристаллических тел. Зависимость физических свойств вещества от направления называется анизотропией. Кристаллические тела анизотропны. Реально анизотропия вещества проявляется в едином кристалле — монокристалле. Чаще всего твердые тела состоят из множества таких монокристаллов, ориентированных случайным образом. При этом анизотропные свойства вещества маскируются. Твердое тело, состоящее из множества хаотически расположенных монокристаллов, называется поликристаллическим. 5.6. Фазы. Равновесие фаз.
Состояние вещества с определенной симметрией (упорядоченностью) называется фазовым состоянием или фазой вещества. Примеры: газ, жидкость, кристаллы одного и того же вещества будут различными фазовыми состояниями этого вещества. Все хорошо представляют себе фазовые состояния Н2О — пар, вода и лед. При некоторых условиях фазы могут существовать одновременно в равновесии друг с другом. В этом случае, прежде всего, как и для любых находящихся в равновесии тел, должны быть равны температуры обеих (если их две) фаз: Т 1 = Т 2. Должно выполняться и условие равенства давлений в обеих фазах: р 1 = р 2. Это равенство вытекает из третьего закона Ньютона, который, конечно, действует на поверхности раздела фаз. Кроме того, должна сохраняться сама молекула, в том смысле, который придается этому слову в химии. Вещество не должно изменять свою химическую природу при переходе из одной фазы в другую. Это означает, что должна сохраняться та составляющая внутренней энергии, приходящейся на одну молекулу U / N, которая обязана своим существованием внутреннему строению молекулы, а не теплоте TS (хаотическому движению), и не может быть отдана в виде работы (– рV). Это величина: G = N μ = U – TS + pV. (5.16) Величина G называется термодинамическим потенциалом (потенциалом Гиббса), а μ — химическим потенциалом. Таким образом, на границе равновесных фаз должно выполняться также условие μ1 = μ2. В равновесном состоянии одинаковое число молекул переходит в единицу времени из одной фазы в другую и обратно (динамическое равновесие), поэтому N = const. Дифференцируя (5.16), находим: Nd μ = dU – TdS – SdT + pdV + Vdp. (5.17) Используя, что, в силу первого начала термодинамики, Nd μ = – SdT + Vdp (5.18) или d μ = – sdT + Vdp, (5.19) где s и V — соответственно, энтропия и объем, приходящийся на одну молекулу. Отсюда видно, что химический потенциал μ является функцией давления и температуры. С другой стороны, вычисляя d μ как полный дифференциал, имеем
Сравнивая два последних соотношения между собой, видим, что
При равновесии μ1(р, Т) = μ2(р, Т). Таким образом, при равновесии фаз имеется еще одна (наряду с уравнением состояния) связь между давлением и температурой. Рассматривая, например, давление как функцию температуры, имеем
Поскольку для каждой фазы имеют место соотношения
то получаем
где s 1, V 1и s 2, V 2 — энтропия и объем в расчете на одну молекулу обеих фаз, находящихся в равновесии. В этой формуле удобно выразить разность s 1 – s 2через теплоту q (на одну молекулу) перехода из одной фазы в другую q = T (s 2 – s 1). Находим формулу Клапейрона–Клаузиуса
Это закон, определяющий связь давления и температуры, находящихся в равновесии фаз. Формула Клапейрона–Клаузиуса широко используется в физической химии. Присущая расположению молекул в теле симметрия — это основополагающее свойство тела. Изменение симметрии приводит к изменению очень многих свойств этого тела. Фактически тела становятся другими. Такое превращение называется фазовым переходом. Фазовые переходы в физической химии иногда называют кинетическими превращениями. Далее будут рассмотрены примеры фазовых переходов. Некоторые из них (испарение, конденсация, плавление, кристаллизация) широко распространены и изучаются в любом курсе физики и химии.
|

 , где V = l /τ — скорость растекания на практически любое расстояние l будет очень мала. Можно найти, что:
, где V = l /τ — скорость растекания на практически любое расстояние l будет очень мала. Можно найти, что: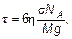 (5.15)
(5.15) (5.20)
(5.20)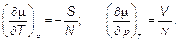 (5.21)
(5.21) (5.22)
(5.22) (5.23)
(5.23)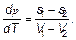 (5.24)
(5.24) (5.25)
(5.25)


