Приложение 1. Скорость химической реакцииСкорость химической реакции. Химическое равновесие I вариант I. Закон действующих масс выражается формулой: 1) k = Ac-Ea/RT 2) V = k · 3) II. Размерность величины скорости химической реакции: 1) моль/л·с 2) м3/с III. Способ, смещающий равновесие реакции CO(г) + С12(г) ⇄ CCl2O(г) вправо, – это: 1) увеличение концентрации продукта; 2) увеличение концентрации хлора; 3) уменьшение концентрации хлора. IV. Способ, смещающий равновесие реакции PCl3(г) + Cl2(г) ⇄ PCl5{r) влево, – это: 1) увеличение концентрации продукта; 2) увеличение концентрации хлора; 3) уменьшение концентрации хлора. V. Способ, смещающий равновесие реакции 2СО(г) ⇄ С(т) + СО2(г) вправо, – это: I) увеличение концентрации угарного газа; 2) увеличение концентрации углекислого газа; 3) уменьшение концентрации твердого продукта. VI. При повышении давления равновесие реакции 2Н2О ⇄ 2H2 + О2 сместится влево. 1) да; 2) нет; 3) не знаю. VII. При понижении давления равновесие реакции 2H2S + 3О2 ⇄ 2SO2 + 2H2O сместится влево. 1) да; 2) нет; 3) не знаю. VIII. При повышении давления равновесие реакции S(т) + 2HI ⇄ I2 + H2S сместится влево. 1) да; 2) нет; 3) не знаю. IX. При понижении температуры равновесие реакции H2 + S ⇄ H2S + Q сместится влево. 1) да; 2) нет; 3) не знаю. X. При повышении температуры равновесие реакции N2 + О2 ⇄ 2NO – Q сместится влево. 1) да; 2) нет; 3) не знаю. XI. При повышении температуры равновесие реакции CaCО3 ⇄ CaO + CО2 – 46 кДж сместится влево. 1) да; 2) нет; 3) не знаю. XII. В какую сторону сместится равновесие реакции СО(г) + Н2О(в) ⇄ СО2(г) + Н(г) при повышении давления? 1) равновесие не нарушится; 2) вправо; 3) влево. XIII. При одновременном повышении температуры и понижении давления равновесие в реакции СО + 2Н2 ⇄ СН3ОН(ж) + Q сместится вправо. 1) да; 2) нет; 3) не знаю. XIV. При одновременном повышении давления и температуры равновесие в реакции С(т) +2N2O ⇄ CO2 +2N2 +Q сместится: 1) вправо; 2) влево; 3) не сместится. II вариант I. Константа скорости химической реакции – это: 1) скорость данного процесса в начальный момент времени; 2) скорость данной реакции при концентрациях реагентов, равных 1 моль/л; II. Какой математической функцией описывается зависимость скорости реакции от температуры? 1) линейной; 3) степенной; 2) логарифмической; 4) показательной. III. Способ, смещающий равновесие реакции 2SO2(г) +О2(г) ⇄ 2SО3(г) вправо, – это: 1) уменьшение концентрации продукта; 2) уменьшение концентрации кислорода; 3) увеличение концентрации продукта. IV. Способ, смещающий равновесие реакции FeO(т) + CO(г) ⇄ Fe(т) + CО2(г) вправо, – это: 1) увеличение концентрации угарного газа; 2) увеличение концентрации углекислого газа; 3) уменьшение концентрации твердого продукта. V. Способ, смещающий равновесие реакции 2СuО(т) + СО ⇄ Сu2O(т) + СО2 вправо, – это: 1) увеличение концентрации угарного газа; 2) увеличение концентрации углекислого газа; 3) уменьшение концентрации твердого продукта. VI. При повышении давления равновесие реакции 4НС1 + О2 ⇄ 2Сl2 + 2Н2О сместится вправо. 1) да; 2) нет; 3) не знаю. VII. При понижении давления равновесие реакции СО + Н2О ⇄ СО2 + Н2 сместится влево. 1) да; 2) нет; 3) не знаю. VIII. При повышении давления равновесие реакции Н2 + СО ⇄ Н2О + С(т) сместится вправо. 1) да; 2) нет; 3) не знаю. IX. При понижении температуры равновесие реакции 2SO3 ⇄ 2SO2 + О2 – Q сместится вправо. 1) да; 2) нет; 3) не знаю. X. При повышении температуры равновесие реакции 2СО + О2 ⇄ 2СО2 + Q сместится влево. 1) да; 2) нет; 3) не знаю. XI. При повышении температуры равновесие реакции FeO + СО ⇄ Fe + СО2 +17 кДж сместится вправо. 1) да; 2) нет; 3) не знаю. ХII. Сместить равновесие реакции Н2 + S ⇄ H2S + Q вправо, можно: 1) повысив температуру; 2) понизив температуру. XIII. При одновременном повышении температуры и понижении давления равновесие в реакции 2HBr ⇄ H2 + Вr2(ж) – Q сместится вправо. 1) да; 2) нет; 3) не знаю. XIV. Выход продуктов реакции 3Fe(т) + 2СО ⇄ Fe3C(т) + CO2 + 149 кДж при одновременном повышении давления и понижения температуры: 1) увеличится; 2) уменьшится; 3) не изменится.
|


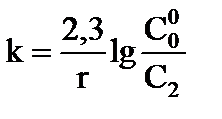 4)
4) 



