ТЕМА 6. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ.
Ряд свойств растворов (давление пара, температуры кипения и замерзания, осмотическое давление) зависят только от концентрации частиц растворенного вещества (молекул, ионов или их ассоциатов) и не зависят от природы этих частиц. Эти свойства носят общее название коллигативных. Давление насыщенного пара растворителя над раствором. Каждое вещество в жидком состоянии характеризуется определенным давлением его насыщенного пара. Это давление, которое создается в замкнутом объеме над испаряющейся жидкостью, при равенстве скоростей испарения жидкости и конденсации ее паров. Давление насыщенных паров растет с увеличением абсолютной температуры по экспоненциальному закону. Если в жидкости-растворителе с определенным давлением насыщенных паров растворить нелетучее вещество, то давление насыщенных паров растворителя уменьшится. Закон Рауля. Для разбавленных растворов неэлектролитов относительное понижение давления насыщенного пара растворителя над раствором пропорционально мольной доле нелетучего растворенного вещества.
Сумма мольных долей всех веществ в растворе равна 1. В двухкомпонентной системе «растворитель А – растворенное вещество В»
т.е. давление насыщенного пара над раствором Повышение температуры кипения и понижение температуры замерзания раствора. Жидкость кипит, когда давление насыщенного пара растворителя над раствором становится равным атмосферному давлению. Поскольку растворение нелетучего вещества понижает давление паров растворителя, то для достижения атмосферного давления требуется более высокая температура раствора. Первое следствие из закона Рауля: температура кипения раствора выше температуры кипения растворителя. Согласно второму следствию из закона Рауля: температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя. Это обусловлено более низким давлением пара растворителя над раствором, чем над растворителем. Повышение температуры кипения и понижение температуры замерзания раствора пропорциональны моляльности растворенного вещества Сm(B), моль/кг.
Коэффициентами пропорциональности служат соответственно криоскопическая (Kт) и эбуллиоскопическая (Эт) константы растворителя. Для воды: Осмотическое давление. Самопроизвольный переход растворителя через полупроницаемую перегородку, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом. Полупроницаемая перегородка - это мембрана искусственного или естественного происхождения с мельчайшими порами, размеры которых позволяют проникать через нее небольшим молекулам растворителя, но не позволяют проникать крупным молекулам растворенного вещества. Молекулы растворителя самопроизвольно проникают из менее концентрированного раствора в более концентрированный, тем самым, разбавляя его. Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади поверхности, и заставляющей молекулы растворителя проникать через полупроницаемую перегородку. Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры согласно закону Вант-Гоффа:
где π; - осмотическое давление, кПа; СВ – молярная концентрация вещества, моль/л; Vр-ра – объем раствора, л; Т – температура, К; R – универсальная газовая постоянная (8,314 л· кПа· К-1· моль-1; Дж/моль ∙К)
Особенности физико-химических свойств растворов электролитов. Наблюдаемые экспериментально значения Следовательно, для электролитов:
Физический смысл изотонического коэффициента:
Для электролитов Способность вещества к диссоциации количественно характеризуется степенью диссоциации. Степень диссоциации (
α =
где
|

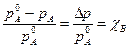 (6.1)
(6.1) - мольнаядоля нелетучего вещества (неэлектролита),
- мольнаядоля нелетучего вещества (неэлектролита), - давление пара чистого растворителя (А),
- давление пара чистого растворителя (А),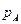 - давление пара растворителя над раствором,
- давление пара растворителя над раствором, - понижение давления пара растворителя над раствором по сравнению с чистым растворителем.
- понижение давления пара растворителя над раствором по сравнению с чистым растворителем. . Заменив в (6.1)
. Заменив в (6.1)  , получим:
, получим:
 ,
, 
 =
=  (6.2)
(6.2) нелетучего неэлектролита равно произведению давления насыщенного пара чистого растворителя на мольную долю растворителя в растворе.
нелетучего неэлектролита равно произведению давления насыщенного пара чистого растворителя на мольную долю растворителя в растворе. (6.3)
(6.3) , (6.4)
, (6.4) К/кг·моль-1,
К/кг·моль-1,  К/кг·моль-1.
К/кг·моль-1. (6.5)
(6.5) , названный впоследствии изотоническим коэффициентом.
, названный впоследствии изотоническим коэффициентом. ;
;  ;
; 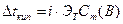 ;
;  (6.6)
(6.6) (6.7)
(6.7) ) равна отношению числа продиссоциировавших молекул к общему числу молекул, введенных в раствор. Степень диссоциации слабых электролитов значительно меньше единицы. Значения степени диссоциации сильных электролитов, определяемые по данным измерения электропрводности растворов, называются кажущимися. Изотонический коэффициент связан с кажущейся степенью диссоциации электролита соотношением:
) равна отношению числа продиссоциировавших молекул к общему числу молекул, введенных в раствор. Степень диссоциации слабых электролитов значительно меньше единицы. Значения степени диссоциации сильных электролитов, определяемые по данным измерения электропрводности растворов, называются кажущимися. Изотонический коэффициент связан с кажущейся степенью диссоциации электролита соотношением: , отсюда i =
, отсюда i =  -1)+1 (6.8)
-1)+1 (6.8) – суммарное число ионов, на которые диссоциирует одна молекула электролита. Для NaCl
– суммарное число ионов, на которые диссоциирует одна молекула электролита. Для NaCl 


