Классификация органических реакций Лекция 3
Тема: Классификация химических реакций
Цель:знакомство с классификацией химических реакций
План:
1. Основные понятия: реакционный центр, субстрат, реагент.
2. Классификация по типу разрыва химических связей.
3. Классификация по количеству и характеру исходных и конечных продуктов различают типы реакций.
Химические реакции – это процессы, сопровождающиеся изменением распределения электронов внешних оболочек атомов реагирующих веществ. В ходе реакции в молекулах реагирующих веществ разрываются одни химические связи и образуются другие. Реакция идет в сторону образования стабильных частиц, т.е. обладающих меньшей внутренней энергией. Способность вещества вступать в химическое взаимодействие и реагировать с другим веществом с большей или меньшей скоростью называется его реакционной способностью. Вещество, которое вступает в реакцию, в органической химии принято называть субстратом. Субстратом называют то вещество, в котором у атома углерода происходит разрыв старой и образование новой связи. Вещество, которым действуют на субстрат – реагентом. Различают три типа реагентов: 1. радикалы (R) – это нейтральные атомы или частицы с неспаренным электроном (Н×, С1×, ×ОН, ×СН3 и др.); 2. нуклеофилы (Nu – «любящие ядра») – это частица, имеющая электронную пару на внешнем электронном уровне атома (Н–, НО–, Наl–, Н2О:,:NН3, СН2=СН2, С6Н6 и др.); 3. элекрофилы (Е – «любящие электроны») – это частицы, имеющие недостаток электронов – незаполненный валентный электронный уровень (катионы Н+, NО2+, молекулы А1С13, SО3 и др.).
Субстрат реагент
реакционный центр Реакционный центр – это атом или группа атомов, непосредственно участвующих в данной химической реакции. Механизм реакции – это последовательность элементарных стадий реакций, через которые проходят реагенты, превращаясь в продукты реакции. Органические реакции классифицируют по различным признакам. I. Классификация по типу разрыва химических связей в реагирующих частицах. 1.. Радикальные реакции – это процессы, идущие с радикальным (гомолитическим) разрывом ковалентной связи. При радикальном разрыве связи электронная пара, осуществляющая ковалентную связь, делится так, что каждый атом оставляет себе «свой» электрон. Например:
Субстрат(S) Реагент
В результате такого разрыва связи образуются свободные радикалы. Атом или группа атомов, имеющие неспаренный (нечетный) электрон называется свободным радикалом. При написании свободного радикала обычно пишут точку для обозначения неспаренного электрона, так же как пишут знак плюс или минус при обозначении иона. Обычно радикалы очень активны и атакуют молекулы по месту с высокой электронной плотностью. Простыми примерами радикалов являются атомы водорода и хлора. 2. Ионные реакции – это процессы, идущие с ионным (гетеролитическим) разрывом ковалентных связей. В этом случае электронная пара, осуществляющая ковалентную связь, полностью отходит к одному из атомов, соединённых ковалентной связью. В зависимости от природы атакующего реагента реакции могут быть электрофильными (символ Е) и нуклеофильными (N).Например: Br: Br → Br+ + [:Br]ˉ В результате такого разрыва связи образуются ионы. Ионы это атомы или группы атомов, несущие заряд. В реакциях нуклеофил атакует в субстрате реакционный центр с недостатком электронов, электрофил атакует реакционный центр с избытком электронов. Соответственно этому различают: I. Электрофильные реакции
Nu (S) Е (реагент) электрофил
Субстрат реагент нуклеофил
II. Классификация по количеству и характеру исходных и конечных продуктов различают типы реакций: 1. Реакции замещения (S). Различают реакции нуклеофильного замещения (SN), электрофильного замещения (SЕ) и радикального замещения (SR). Реакция (SN). Взаимодействие спиртов с галогеналканами СН3 - ОН- + Н - Br- ® СН3Br + H2O Е Nu Реакция (SЕ). нитрование бензола
Реакции радикального замещения (SR)
|


 В ходе химического превращения обычно затрагивается не вся молекула, а только её часть, которая называется реакционным центром.
В ходе химического превращения обычно затрагивается не вся молекула, а только её часть, которая называется реакционным центром.

 Кислотный
Кислотный
 Н3С: Н + С1: С1
Н3С: Н + С1: С1  СН3С1 + НС1
СН3С1 + НС1



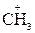 II. Нуклеофильные реакции
II. Нуклеофильные реакции : С1- + Nа+: ОН- ® СН3ОН + NаС1
: С1- + Nа+: ОН- ® СН3ОН + NаС1



