Эквивалент Э(X) – реальная или условная частица вещества X, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции – одному электрону.
Фактор эквивалентности fэ(X) – число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции (Таблица 1).
Молярная масса эквивалента веществаMэ(X) – масса одного моля эквивалента этого вещества. Она равна произведению фактора эквивалентности на молярную массу вещества X:
Mэ(X) = fэ(X) ∙ M(X). (1.1)
Количество вещества эквивалента nэ(X) – количество вещества в молях, в котором частицами являются эквиваленты. Его находят как отношение массы вещества к молярной массе эквивалента вещества:
 . (1.2)
. (1.2)
Эквивалентный объем или объем моля эквивалента Vэ(X) – это объем, который занимает один моль эквивалентов газообразного вещества при нормальных условиях (н.у.).
В результате работ И. Рихтера был открыт закон эквивалентов (1793 г.): все вещества реагируют друг с другом в количествах, пропорциональных их эквивалентам.
Смысл этого закона заключается в том, что моль эквивалентов одного вещества реагирует точно с молем эквивалентов другого вещества, а n молей эквивалентов одного вещества с n молями эквивалентов другого вещества.
Математически закон эквивалентов можно записать:
 , (1.3)
, (1.3)
Таблица 1 – Формулы расчета фактора эквивалентности
| Частица
| Фактор эквивалентности
| Примеры
|
| Элемент
| fЭ (В) = 1/В(Э),
где В (Э) – валентность элемента
| Фактор эквивалентности хрома в оксиде хрома (III) 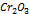 : fЭ ( : fЭ (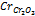 ) = 1/3 ) = 1/3
|
| Простое
вещество
| fЭ (В) = 1/n(Э)·В(Э),
где n (Э) – число атомов элемента (индекс в химической формуле),
В (Э) – валентность элемента
| f Э(H2) = 1/(2×1) = 1/2;
f Э(O2) = 1/(2×2) = 1/4;
f Э(Cl2) = 1/(2×1) = 1/2;
f Э(O3) = 1/(3×2) = 1/6
|
| Оксид
| fЭ (В) = 1/n(Э)·В(Э),
где n (Э) – число атомов элемента (индекс в химической формуле оксида),
В (Э) – валентность элемента
| f Э(Cr2O3) = 1/(2×3) = 1/6;
f Э(CrO) = 1/(1×2) = 1/2;
f Э(H2O) = 1/(2×1) = 1/2;
f Э(P2O5) = 1/(2×5) = 1/10
|
| Кислота
| fЭ (В) = 1/n(Н+),
где n (H+) – число отданных в ходе реакции ионов водорода (основность кислоты)
| f Э(H2SO4) = 1/1 = 1 (основность равна 1)
или
f Э(H2SO4) = 1/2
(основность равна 2)
|
| Основание
| fЭ (В) = 1/n(OН-),
где n (ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
| f Э(Cu(OH)2) = 1/1 = 1 (кислотность равна 1) или
f Э(Cu(OH)2) = 1/2
(кислотность равна 2)
|
| Соль
| fЭ (В) = 1/n(Me)·В(Me)= 1/n(А)·В(А),
где n (Ме) – число атомов металла (индекс в химической формуле соли),
В (Ме) – валентность металла; n (А) – число кислотных остатков, В (А) – валентность кислотного остатка
| f Э(Cr2(SO4)3) = 1/(2×3) = 1/6 (расчет по металлу) или
f Э(Cr2(SO4)3) = 1/(3×2) = 1/6 (расчет по кислотному остатку)
|
| Частица в окислительно-восстановительных реакциях
| fЭ (В) = 1/ 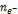 ,
где ,
где  – число электронов, участвующих в процессе окисления или восстановления – число электронов, участвующих в процессе окисления или восстановления
| Fe2+ + 2e- → Fe0
f Э(Fe2+) =1/2;
|
| Ион
| fЭ (В) = 1/z,
где z – заряд иона
| f Э(SO42–) = 1/2
|
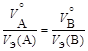 , (1.4)
, (1.4)
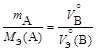 , (1.5)
, (1.5)
где m – массы веществ A и B;
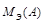 ,
, 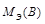 – молярные массы эквивалентов веществ A и B;
– молярные массы эквивалентов веществ A и B;
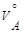 ,
, 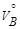 – объемы газов A и B при н.у.;
– объемы газов A и B при н.у.;
 ,
, 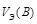 – эквивалентные объемы газов A и B при н.у.
– эквивалентные объемы газов A и B при н.у.
Молярная масса эквивалента сложного вещества обладает свойством аддитивности и равна сумме молярных масс эквивалентных его составляющих частей [1]:
Mэ (AxBy) = Mэ (A) + Mэ (B) (1.6)

 . (1.2)
. (1.2) , (1.3)
, (1.3)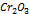 : fЭ (
: fЭ (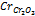 ) = 1/3
) = 1/3
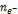 ,
где
,
где  – число электронов, участвующих в процессе окисления или восстановления
– число электронов, участвующих в процессе окисления или восстановления
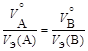 , (1.4)
, (1.4)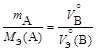 , (1.5)
, (1.5)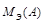 ,
, 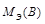 – молярные массы эквивалентов веществ A и B;
– молярные массы эквивалентов веществ A и B;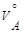 ,
, 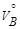 – объемы газов A и B при н.у.;
– объемы газов A и B при н.у.; ,
, 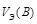 – эквивалентные объемы газов A и B при н.у.
– эквивалентные объемы газов A и B при н.у.


