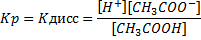Степень диссоциации различных электролитов(при См= 1 моль/литр, =25 ºС)
Концентрация ионов в растворе электролита зависит от молярной концентрации См, степени диссоциации α и числа ионов данного вида ni, на которое распадается молекула электролита. Сионов=См∙αni. Например, для раствора Н2SO4 0,5 моль/л при α=50% концентрация ионов водорода [Н+]=0,5∙0,5∙2 моль/л. Все соли, за исключением HgCl2 и Fe(CHS)3 – сильные электролиты. Сильные и слабые электролиты имеют свои особенности. При растворении слабых электролитов в воде происходит обратимая диссоциация, например, для СН3СООН имеет место равновесие: СН3СООН Для обратимого равновесного процесса можно применить закон действующих масс. Константа равновесия в данном случае называется константой диссоциации:
Константа диссоциации характеризует способность слабого электролита к распаду на ионы. Чем меньше величина Кдисс, тем слабее электролит. Например, КСН3СООН = 1,82∙10-5, КНСN= 7,2∙10‾ ¹º, КНСN<КСН3СООН, т.е. НСN – более слабая кислота. Обратимая диссоциация происходит в растворе слабого основания, например NН4ОН
Кдисс = 1,76∙10-5, т.е. NН4ОН – слабое основание. Если электролит диссоциирует по ступеням, то каждая ступень характеризуется своей константой диссоциации: Н3РО4 Н2РО4 НРО4 Диссоциация в основном идёт по первой ступени, по третьей ступени на электролит практически не диссоциирует, о чём свидетельствует малая величина К3. Удобнее пользоваться не величинами Кдисс, а величинами рК – показателями кислоты и основания: pКкислоты = -lgКкислоты, рКоснования =-lgКоснования. Для Н3Р04: рК1=2,12; рК2= 7,21; рК3= 12,26. Для характеристики свойств амфотерных электролитов необходимо знать величины констант диссоциации по кислотному и основному типам. По соотношению величин этих констант можно судить о преобладании тех или иных свойств у амфотерного электролита. Напомним, что диссоциация амфотерного электролита проходит по R++ ОНֿ Тогда для Ве(0Н)2, например, равновесие диссоциации имеет вид: Ве²++ 2OHֿ константа диссоциации по основному типу:
по кислотному типу
Поскольку Коск>Ккисл, у Ве(ОН)2 преобладают основные свойства. В случае А1(0Н)3 Косн = 8 ∙10-25, Ккисл = 4∙10-13, следовательно, у А1(OН)3 преобладают кислотные свойства. Примером электролита, у которого основные и кислотные свойства выражены примерно одинаково, может служить Ga(OH)3, у которого Ккисл=2∙10-12. Константа диссоциации зависит от природы вещества и температуры, но не зависит от концентрации, поэтому она дает более общую
|

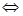 Н+ +СН3СОО‾, т.е. процесс обратим.
Н+ +СН3СОО‾, т.е. процесс обратим.